
- •Биохимия животных Электронный дидактический комплекс (эдк)
- •Физическая химия вода
- •Активная реакция водных растворов
- •Ионное произведение воды. Водородный показатель
- •Методы определения рН среды
- •Роль активной реакции среды в биологических процессах
- •Буферные pacтворы, состав, механизм действия
- •Буферная емкость
- •Биологическое значение буферных систем
- •Коллоидная химия
- •Классификация дисперсных систем
- •Поверхностные явления
- •Адсорбция
- •Коллоидные растворы (золи) Методы получения
- •Строение коллоидных частиц
- •Коагуляция. Седиментация. Пептизация
- •Молекулярно-кинетические свойства коллоидных растворов
- •Осмотическое давление
- •Биологическое значение явления осмоса
- •Механизмы, участвующие в сохранении изоосмии:
- •Оптические свойства коллоидных систем
- •Растворы высокомолекулярных соединений
- •Свободная и связанная вода в коллоидных pacтвopax
- •Свойства растворов вмс
- •Денатурация
- •2. Белки; биологическая роль Аминокислоты
- •Содержание белков в организме и тканях
- •Методы выделения белков
- •Методы фракционирования и очистки белков
- •Физико-химические свойства белков
- •Аминокислоты
- •Ациклические аминокислоты
- •Структура белковой молекулы
- •Классификация белков
- •Химия сложных белков
- •3. Нуклеиновые кислоты
- •Нуклеотиды и нуклеозиды
- •Структура днк
- •Рибонуклеиновые кислоты
- •4. Ферменты
- •Биосинтез и клеточная локализация ферментов
- •Химическая природа ферментов
- •Строение ферментов
- •Активный центр фермента
- •Регуляция активности ферментов
- •Механизм действия ферментов
- •Основные свойства ферментов
- •2. Зависимость активности ферментов от рН среды.
- •Факторы, определяющие активность ферментов
- •Активирование и ингибирование ферментов
- •Типы ингибирования
- •Классификация и номенклатура ферментов
- •Применение ферментов.
- •Использование иммобилизованных ферментов для производства биологических соединений
- •Иммуноферментный анализ и его использование в ветеринарии
- •5. Химия витаминов
- •Классификация и номенклатура витаминов
- •I. Жирорастворимые витамины
- •II. Витамины, растворимые в воде
- •Витамин d, антирахитический, кальциферол
- •Витамин e, антистерильный, токоферолы
- •Витамин к, антигеморрагический (филлохинон)
- •Витамин q (убихинон)
- •Водорастворимые витамины
- •Витамин b1, антиневритный, тиамин
- •Витамин b2, рибофлавин
- •Витамин b3, пантотеновая кислота
- •Витамин b5, pp, никотинамид, ниацин, антипеллагрический
- •Витамин b6, адермин, пиридоксол
- •Витамин b12, кобаламин, антианемический
- •Фолиевая кислота
- •Витамин с (аскорбиновая кислота)
- •Биотин, витамин h
- •6. Гормоны
- •Гормоны гипофиза
- •Поджелудочная железа
- •Гормоны щитовидной железы
- •Гормоны надпочечников
- •Гормоны коры надпочечников
- •Гормоны половых желез
- •Гормоны тимуса (вилочковой железы)
- •Гормоны местного действия
- •7. Обмен веществ и энергии
- •Основные этапы обмена веществ
- •Биологическое окисление
- •Окислительное фосфорилирование
- •Токсичность кислорода
- •8. Химия и обмен углеводов
- •Моносахариды
- •Производные моносахаридов.
- •Полисахариды (гликаны)
- •Гетерополисахариды (гетерогликаны)
- •Обмен углеводов
- •Катаболизм глюкозы
- •Гликогенолиз
- •Биосинтез углеводов
- •Биосинтез гликогена (гликогенез)
- •Регуляция углеводного обмена.
- •9. Химия и обмен липидов
- •Химическое строение нейтральных жиров
- •Жирные кислоты.
- •Нейтральные гликолипиды
- •Фосфолипиды (фосфатиды)
- •Сфинголипиды
- •Двойной липидный слой мембран
- •Обмен липидов
- •Переваривание липидов в желудочно-кишечном тракте
- •Промежуточный обмен липидов
- •Энергетический баланс β-окисления жирных кислот
- •Метаболизм ацетил-коэнзима а
- •Пути образования кетоновых тел
- •Биосинтез липидов
- •Метаболизм стеринов и стеридов
- •Липосомы
- •10. Обмен белков
- •Биологическая ценность белков
- •Нормы белка в питании животных
- •Белковые резервы организма
- •Обмен простых белков
- •Переваривание белков в желудочно-кишечном тракте моногастричных животных
- •Переваривание белков в кишечнике.
- •Особенности переваривания белков у жвачных животных
- •Дезаминирование аминокислот
- •Трансаминирование – непрямой путь дезаминирования аминокислот
- •Декарбоксилирование аминокислот
- •Окислительное расщепление аминокислот
- •Особенности обмена отдельных аминокислот
- •11. Биосинтез белка
- •Генетический код
- •Этапы синтеза белка
- •Мультиферментный механизм синтеза белка
- •12.Обмен нуклеиновых кислот Переваривание нуклеиновых кислот в желудочно-кишечном тракте
- •Промежуточный обмен нуклеиновых кислот Распад нуклеиновых кислот в тканях
- •Пиримидиновые основания
- •Биосинтез нуклеиновых кислот
- •Рекомбинантные молекулы и проблемы генной инженерии
- •Клонирование животных
- •Метод молекулярной гибридизации
- •Принцип метода
- •Способы гибридизации
- •Метод блоттинга по Саузерну
- •Полимеразная цепная реакция (пцр)
- •Необходимые приборы и реактивы
- •13. Обмен воды и солей
- •Вода, ее содержание и роль в организме
- •Потребность животного организма в минеральных веществах, их поступление и выделение
- •Микроэлементы
- •14. Биохимия крови
- •Физико-химические свойства крови
- •Буферные системы крови
- •Плазма крови и ее химический состав
- •Белки плазмы и сыворотки крови
- •Небелковые азотистые вещества крови
- •Форменные элементы крови
- •15. Биохимия мышечной ткани
- •Механизм сокращения мышцы
- •Азотистые экстрактивные вещества мышц
- •Минеральные вещества
- •Окоченение мышц
- •16. Биохимия молока и молокообразования
- •17. Биохимия почек и мочи
- •Патологические компоненты мочи
- •Особенности мочи птиц
- •18. Биохимия кожи и шерсти
- •19. Биохимия яйца
- •Биосинтез компонентов яйца
- •Предметный указатель
- •Приложения
- •Рекомендуемая литература
- •Тесты для проверки биохимических
- •Глава 8. Химия обмена углеводов
- •24. Сложноэфирные связи в молекулах триацилглицеролов подвергаются ферментативному гидролизу при участии:
- •Глава 11. Синтез белка
- •Глава 12. Обмен нуклеиновых кислот
- •Глава 13. Биохимия почек и мочи
Буферная емкость
Предел, в котором проявляется буферное действие, называется буферной ёмкостью. Её выpaжaют количеством грамм-эквивалентов сильной кислоты или сильного основания, которые следует добавить к 1 л буферного раствора, чтобы сместить его рН на 1 единицу.
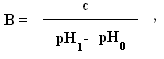
Где В – буферная емкость; с – количество грамм-эквивалентов; рНо– водородный показатель до добавления сильной кислоты или основания; рН1– водороднй показатель после добавления.
Наибольшей буферной емкостью обладают концентрированные буферные растворы. Из буферных растворов с равной концентрацией наибольшей емкостью будут обладать те, которые составлены из равного количества компонентов.
Биологическое значение буферных систем
Буферные системы в живых организмах поддерживают постоянство рН в крови и тканях. Исследования показали, что в процессе обмена веществ в организме образуется большое количество кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20-30 л I н. сильной кислоты. Сохранение постоянства рН среды в организме обеспечивается наличием в нем мощных буферных систем.
Большую роль при этом играют белковый, бикарбонатный и фосфатный буферы. Буферной системой крови являются бикарбонатный и фосфатный буферы: Н2С03 + NaHCO3; NaH2P04 + Na2НРО4 соответственно.
Однако наиболее мощной буферной системой крови является гемоглобиновый буфер (75% всей буферной ёмкости крови), который удаляет из организма большое количество углекислоты.
Большое значение в поддержании постоянного рН в клетках тканей имеет белковый буфep. Он состоит из протеина (белка) –Ptи его соли. Компоненты этого буфера можно представить как:
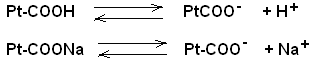
Коллоидная химия
Коллоидная химия изучает физическую химию гетерогенных высокодисперсных систем и растворов высокомолекулярных соединений.
Дисперсные системы – это системы, состоящие из вещества, раздробленного или размельченного до частиц определенной величины, равномерно распределенного в другом веществе.
Распределяемое вещество – дисперсная фаза, а вещество, в котором распределена дисперсная фаза – дисперсионная среда.
Классификация дисперсных систем
А. По величине частиц дисперсной фазы все дисперсные системы дeлят на 3 группы:
|
Вид системы |
Размер частиц |
Примеры |
Свойства системы |
|
I.Грубодис- персные |
более 100 нм |
Суспензии (твердая фаза в жидкой среде): раствор цемента, кофе, крахмала. Эмульсии (две несмешивающиеся жидкости: молоко, масло в воде) |
Системы гетерогенны, неустойчивы, со временем фазы их разделяются. |
|
II.Коллоидно-дисперсные (коллоидные растворы) или золи |
от 1 до 100 нм |
Золь берлинской лазури, твердые сплавы, туман и др. |
Микрогетерогенные системы, не оседают под действием силы тяжести, не проходят через мембраны, интенсивно окрашены, рассеивают лучи света. В зависимости от природы растворителя золи называют гидрозоли (если дисперсионная среда – вода) и аэрозоли (если дисперсионная среда – воздух). |
|
III. Молекулярно- и ионнодисперсные (ис- тинные р-ры) |
1 нм |
Растворы сахара, спиртов, электролитов (NaCl, HCl, NaOH и др.) |
Гомогенные однофазные системы |
К истинным растворам принадлежат и растворы высокомолекулярных веществ, молекулярная масса которых достигает сотен тысяч дальтон. Это тоже гомогенные системы. Но так как размеры их частиц сравнимы с таковыми коллоидных растворов, то они обладают целым рядом свойств коллоидных растворов.
Б. Дисперсные системы классифицируют также и по агрегатному состоянию дисперсной фазы и дисперсионной среды:
|
Дисперсионная среда |
Дисперсная фаза | ||
|
газ |
жидкость |
твердое тело | |
|
Газ |
– |
Аэрозоли (туман, облака) |
Аэрозоли (дымы, пыль и др.) |
|
Жидкость |
Жидкие пены |
Эмульсии (сливочное масло, маргарин, кремы и др.) |
Суспензии и коллоидные растворы |
|
Твердое тело |
Твердые пены (пемза, пенопласты) |
Жемчуг, вода в парафине и т.д. |
Сплавы, драгоценные камни, окрашенные стекла |
С. По степени взаимодействия дисперсной фазы и дисперсионной среды различают: лиофильные (гидрофильные) с сильным взаимодействием фазы и среды и лиофобные со слабым взаимодействием их.
Таким образом, коллоидные растворы представляют coбой частный случай дисперсных систем.
Процессы, протекающие с участием коллоидных систем, играют большое значение для жизнедеятельности организма, а также в металлургии, сельском хозяйстве, производстве бумаги, пластических масс а др.
