
- •1. Зависимость термодинамических функций от температуры
- •2. Фазовое равновесие в однокомпонентных системах
- •Зависимость теплоты фазового перехода от температуры описывается уравнением:
- •С учетом уравнения (21) уравнение (17) в интегральной форме принимает вид
- •3. Закон распределения. Экстракция Закон распределения выражается уравнением
- •4. Термодинамика растворов неэлектролитов
- •Для бинарного раствора парциальные давления компонентов AиBопределяются законом Рауля
- •Отсюда следует
- •Химический потенциал. Активность. Коэффициент активности
- •Коллигативные свойства растворов
- •5. Растворы сильных электролитов
- •6. Химическая кинетика сложных реакций
- •Для мономолекулярных обратимых реакций типа а в дифференциальная форма кинетического уравнения имеет вид
- •Считая концентрации n2o* и о.Стационарными, найти выражение для скорости распадаN2o.
- •7. Поверхностные явления. Адсорбция
- •Адсорбция на границе жидкость – газ
- •Содержание
- •2. Фазовое равновесие в однокомпонентных системах
- •4. Термодинамика растворов неэлектролитов
7. Поверхностные явления. Адсорбция
Адсорбцией называют самопроизвольное концентрирование веществ на поверхности раздела фаз. Вещество, которое адсорбирует другое вещество, называют адсорбентом. Для обозначения адсорбируемого вещества используют термин адсорбат.
Адсорбция описывается уравнением Гиббса
![]() , (23)
, (23)
где C– равновесная концентрация адсорбата в объеме,- поверхностное натяжение. Это уравнение справедливо для всех видов адсорбции.
В случае адсорбции газов уравнение Гиббса (23) приобретает следующий вид:
![]() ,
,
где p– равновесное парциальное давление адсорбата в газовой среде.
Для описания процесса адсорбции применяют также ряд других уравнений. Мономолекулярная адсорбция на однородной поверхности описывается уравнением Ленгмюра
![]() , (24)
, (24)
где K– константа адсорбционного равновесия
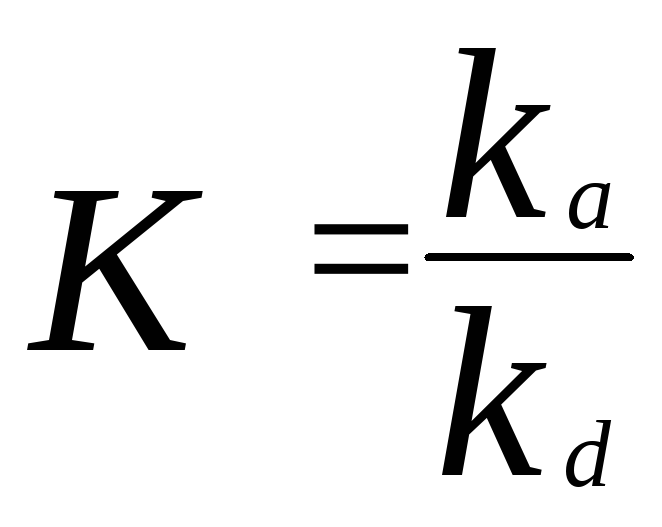
k a и k d – константы скоростей адсорбции и десорбции.
Для мономолекулярной адсорбции газов уравнение Ленгмюра (24) имеет вид:
![]() .
.
Предполагая возможность идеального покрытия поверхности адсорбента мономолекулярным слоем адсорбата, по значениям площади сечения молекул адсорбата S 0 можно рассчитать предельную адсорбцию a :
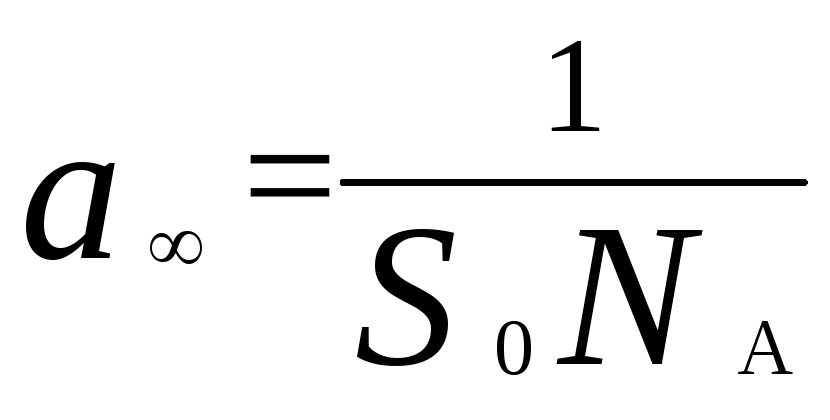 ,
,
где NA– число Авогадро.
Предельную адсорбцию aможно определить по графику зависимости (С / Г) =f (C), полученной преобразованием уравнения изотермы адсорбции Ленгмюра:
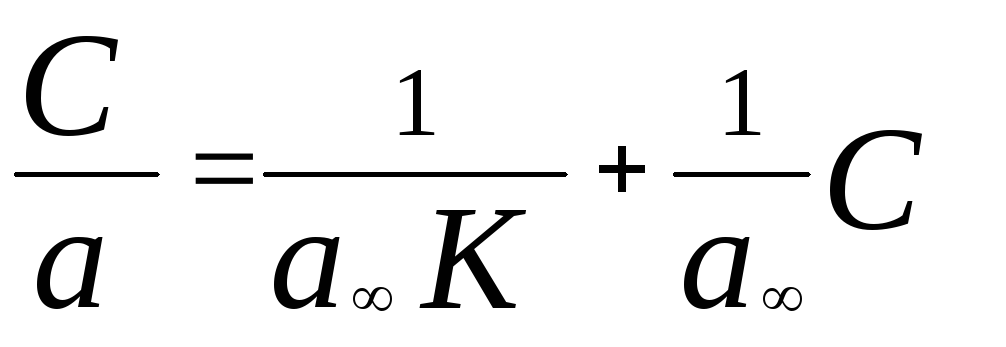 .
.
Зависимость адсорбции от концентрации адсорбата можно определить с помощью эмпирического уравнения Фрейндлиха
![]() , (25)
, (25)
где k,n– коэффициенты, определяемые экспериментально. Для этого прологарифмируем уравнение (25):
![]() .
.
Зависимость lga-lgCхарактеризуется прямой линией, тангенс угла которой равен (1 /n), а отрезок, отсекаемый на оси ординат, равенlgk. Для адсорбции газов также справедливо уравнение Фрейндлиха, имеющее вид:
![]() .
.
Адсорбция на границе жидкость – газ
Адсорбция приводит к изменению поверхностного натяжения жидкости . Вещества, снижающие в результате адсорбции поверхностное натяжение жидкости, называются поверхностно – активными (ПАВ). Вещества, поверхностное натяжение растворов которых по отношению к растворителю увеличивается, называются поверхностно – инактивными (ПИВ).
Способность вещества при адсорбции на границе раздела фаз снижать поверхностное межфазовое натяжение в зависимости от его концентрации в объеме называют поверхностной активностью. Поверхностная активность равна:
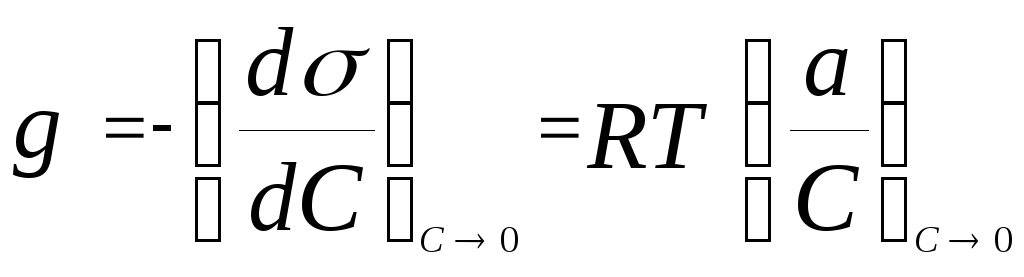 .
.
В случае адсорбции ПАВ g 0 и (d / dC) 0.
Снижение поверхностного натяжения в результате адсорбции ПАВ на границе раздела жидкость – газ можно определить при помощи уравнения Шишковского:
![]() , (26)
, (26)
где A, B – эмпирические коэффициенты.
Пример 20.ПриТ=298 К поверхностное натяжение (σ) воды равно 72,75 мДж / м2
Для 0,05 М раствора уксусной кислоты поверхностное натяжение равно 71, 2 мДж / м2. Рассчитать адсорбцию уксусной кислоты на поверхности раствора.
Решение. Воспользуемся уравнением Гиббса:
![]() .
.
Заменим производную dσ / dCотношением Δσ / ΔC, так как по условию дано только два значения поверхностного натяжения. Тогда:
g=(Δ σ / ΔС) =(71,2 – 72,75). 10– 3/ 0,05.103= 31.10– 6(Дж.м) / моль
После подстановки в уравнение Гиббса получим:
a= 0,05.103· 31· 10 - 6/ 8,314· 298 = 0,626· 10 - 6моль / м2
Пример 21.По приведенным результатам исследования адсорбции пропана на активном угле, проведенного при 200С, составьте уравнение изотермы адсорбции Ленгмюра и определите удельную поверхность угля. Площадь сечения молекул пропана принять равной
1,86 .10– 19м2.
|
p(С3Н8), Торр |
1,0 |
10,0 |
50,0 |
100 |
400 |
700 |
|
a, моль/кг |
0,086 |
0,673 |
1,705 |
2,045 |
2,568 |
2,617 |
Решение. Воспользуемся линейной формой уравнения Ленгмюра в виде:
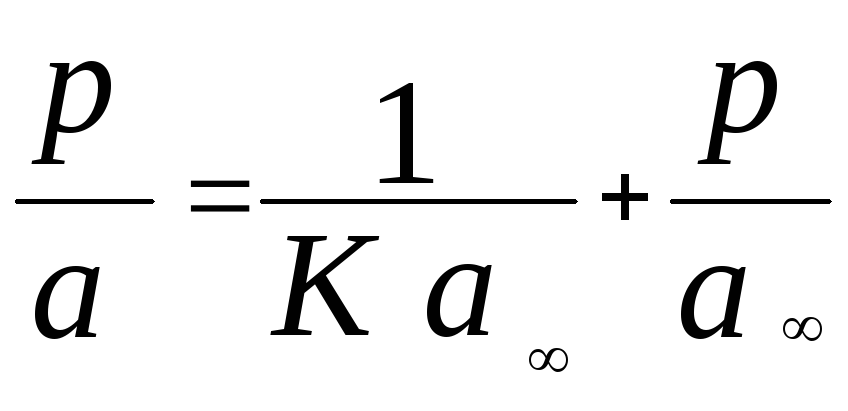 .
.
Составляем вспомогательную таблицу
|
p , Торр |
1,0 |
10,0 |
50,0 |
100 |
400 |
700 |
|
p / a, Торр . моль – 1 . кг |
11,628 |
14,859 |
29,326 |
48,900 |
155,763 |
267,482 |
Данные таблицы представим
в виде графика p
/ a
= f
(p).
Угловой коэффициент равен
![]() ,
а по отрезку, отсекаемому на оси ординат,
определяется величина
,
а по отрезку, отсекаемому на оси ординат,
определяется величина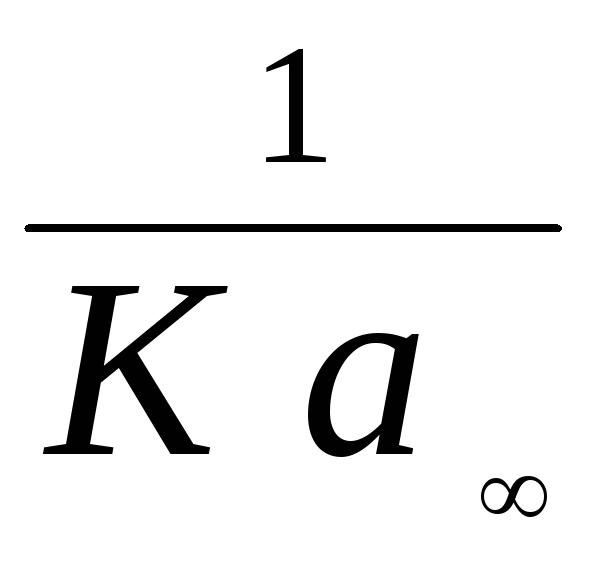 . Получаем следующие результаты:
. Получаем следующие результаты:![]() ;b
= 0,033.
;b
= 0,033.
Более точные значения
параметров
![]() иK
получаются при статистической обработке
данных, например, методом наименьших
квадратов. Вычисляем удельную поверхность:
иK
получаются при статистической обработке
данных, например, методом наименьших
квадратов. Вычисляем удельную поверхность:
S уд = a S 0 N A = 2,74 моль/кг . 1,86.10– 19м2 .6,022.1023моль– 1= 30,7 .10 4м 2 /кг.
Задачи
202. При изучении адсорбции уксусной кислоты на угле при 25 0С были получены следующие данные:
-
С, ммоль/ см3
0,018
0,031
0,062
0,126
a, ммоль/г
0,467
0,624
0,801
1,11
Определить графически константы в уравнении изотермы адсорбции Фрейндлиха.
203. При изучении адсорбции уксусной кислоты на угле при 25 0С были получены следующие данные:
-
С, ммоль/ см3
0,268
0,471
0,882
a, ммоль/г
1,55
2,04
2,48
Определить графически константы в уравнении изотермы адсорбции Фрейндлиха.
204. По уравнению Фрейндлиха вычислить равновесную концентрацию уксусной кислоты, если 1 г угля адсорбирует 3,76 ммоль СН3СООН. Константаk= 2,82;n=2,44.
205. При изучении адсорбции ацетона древесным активированным углем при 20 0С были получены следующие данные:
-
С, ммоль/л
2,34
14,65
88,62
177,69
268,97
a, ммоль/г
0,208
0,618
1,50
2,08
2,88
Определить графически постоянные уравнения изотермы Фрейндлиха и рассчитать количество ацетона, адсорбируемое 1 г угля при равновесной концентрации ацетона 125 ммоль/л.
206. Определить постоянные уравнения Фрейндлиха, используя следующие данные для адсорбции при 231 К углекислого газа на угле:
|
р (CO 2) . 10 – 3, Па |
1,00 |
4,48 |
10,00 |
14,40 |
25,00 |
45,20 |
|
Адсорбция a . 10 2, кг/кг |
3,23 |
6,67 |
9,62 |
11,72 |
14,50 |
17,70 |
207. По приведенным данным об адсорбции СО2на угле марки С при (- 420С) определить константы в уравнении Фрейндлиха.
-
р(СО2), Торр
10,0
50,0
100
200
300
400
a, моль/кг
0,659
1,341
1,545
2,000
2,341
2,591
208. По приведенным результатам адсорбции амилового спирта на активном угле марки СКТ при 20 0С составить уравнение изотермы адсорбции Ленгмюра и определить удельную поверхность угля. Площадь поперечного сечения молекул амилового спирта принять равной
1,6 .10– 19м2.
-
С, моль/ м3
0,94
1,83
3,10
5,60
11,05
a, моль/ кг
0,61
1,21
1,76
2,65
3,96
209. По приведенным данным для адсорбции уксусной кислоты на древесном угле при 25 0С составить уравнение изотермы адсорбции Фрейндлиха.
-
С, моль / л
0,05
0,10
0,50
1,00
1,50
a, г / г
0,04
0,06
0,12
0,16
0,19
210. По приведенным результатам адсорбции СО2на угле марки С при (- 420С) составить уравнение изотермы адсорбции Фрейндлиха.
-
р(СО2), кПа
1,00
4,48
10,0
14,4
25,0
45,2
a.103, моль/ кг
7,34
15,2
21,9
26,6
32,9
40,2
Задачи № 211- 214. По приведенным данным: а) построить изотерму адсорбции; б) проверить применимость уравнения Ленгмюра; в) если изотерма не соответствует уравнению Ленгмюра, составить уравнение адсорбции Фрейндлиха.
211. Адсорбция H2Sна цеолитеCaXпри 250С:
|
p (H2S), Торр |
4 |
6 |
16 |
24 |
50 |
78 |
120 |
154 |
238 |
|
a, моль/кг |
0,735 |
0,882 |
1,412 |
1,559 |
1,941 |
2,118 |
2,294 |
2,471 |
2,588 |
212. Адсорбция H2Sна цеолитеNaAпри 250С:
|
p (H2S), Торр |
6 |
14 |
26 |
50 |
76 |
102 |
152 |
182 |
224 |
|
a, моль/кг |
2,294 |
2,941 |
3,235 |
3,529 |
3,765 |
3,882 |
4,059 |
4,176 |
4,298 |
213. Адсорбция H2Sна цеолитеCaА при 250С:
|
p(H2S), Торр |
4 |
6 |
12 |
24 |
50 |
76 |
102 |
152 |
224 |
|
a, моль/кг |
1,588 |
2,824 |
3,294 |
3,765 |
4,176 |
4,353 |
4,471 |
4,647 |
4,706 |
214. Адсорбция H2Sна цеолитеNaХ при 250С:
|
p (H2S), Торр |
6 |
14 |
24 |
50 |
78 |
120 |
154 |
182 |
234 |
|
a, моль/кг |
2,824 |
3,824 |
4,118 |
4,471 |
4,706 |
4,882 |
5,000 |
5,059 |
5,235 |
Задачи №№ 215- 221. Вычислить адсорбцию (a) моль/м2данного вещества по приведенным данным поверхностного натяжения водного раствора и воды ():
|
№ |
Вещество |
s раствора, мДж / м 2 |
Концентра ция, моль/л |
s (Н2О), мДж / м 2 |
Темпера тура, К |
|
215 |
CH3-CH2-COOH Пропионовая кислота |
55,6 |
0,5 |
71,96 |
298 |
|
216 |
CH3-(CH2)3-COOH Валерьяновая кислота |
52,1 |
0,5 |
75,62 |
273 |
|
217 |
CH3COOH Уксусная кислота |
71,2 |
0,05 |
72,75 |
293 |
|
218 |
CH3-CH2-COOH Пропионовая кислота |
67,7 |
0,05 |
72,75 |
293 |
|
219 |
NaCl |
78,4 |
1,3 |
73,6 |
288 |
|
220 |
NaCl |
76,9 |
2,34 |
73,6 |
288 |
|
221 |
CH3COOH Уксусная кислота |
70,9 |
0,125 |
73,6 |
288 |
Задачи № 222 - 226. При адсорбции указанных газов на активированном угле получены следующие результаты (см. табл.). Вычислить постоянные в уравнении Лэнгмюра для газовой адсорбции.
|
№ |
газ |
Давление, Па |
Количество адсорбированного газа |
Т, К |
|
222 |
Ar |
31,9 . 103; 130,5 . 103; 290 . 103 |
5; 15,4; 24 мг/г |
194,7 |
|
223 |
Kr |
1,35 . 104; 2,63 . 104; 3,93 . 104 |
0,15; 0,27; 0,38 моль/г |
273 |
|
224 |
CO |
6,63 . 104; 7,94 . 104; 9,25 . 104 |
0,55; 0,62; 0,68 моль/г |
273 |
|
225 |
CO2 |
4,8 . 10-1; 11,9 . 10-1; 20,6 . 10-1 |
0,122; 0,195; 0,255 моль/г |
298 |
|
226 |
N2 |
2,8 . 10-1; 6,1 . 10-1; 17,3 . 10-1; |
0,65; 0,75; 0,85 моль/г |
293 |
Задачи № 227 - 229. Построить изотерму поверхностного натяжения, используя значения поверхностных натяжений водных растворов данных веществ при указанной температуре (см.табл.), если поверхностное натяжение воды при 293 К равно 72,75 м Дж / м2, а при 298 К – 71,96 м Дж/м 2. Определить графически адсорбцию вещества при указанной концентрации.
|
№ |
вещество |
С (ПАВ), ммоль/л |
s ж - г , м Дж/м2 |
С х, ммоль/л |
Т, К |
|
227 |
Додецилсульфат натрия |
2,16; 3,96; 6,6; 8,3; 9,3; 9,8; 10,2; 11,2 |
62; 54; 47; 43; 42; 41; 41; 41 |
5,0 |
293 |
|
228 |
Уксусноэтиловый эфир |
7,8; 15,6; 31,2; 62,5; 12,5; 250; 500 |
69,6; 68; 65,8; 61,5; 56,2; 49,7; 41,5 |
20,0 |
298 |
|
229 |
Уксусноэтиловый эфир |
5,3; 7,4; 19,5; 30,2; 60,7; 120,8; |
63; 62,2; 60,1; 54,2; 48,5; 40,3 |
50,0 |
293 |
№ 230. По приведенным результатам массовой адсорбции пентанола на активированном угле при температуре 20°С построить изотерму адсорбции и составить уравнение адсорбции.
|
С, моль/м 3 |
0,94 |
1,83 |
3,1 |
5,6 |
11,05 |
|
a, моль/ кг |
0,61 |
1,21 |
1,76 |
2,65 |
3,96 |
№ 231 - 236. Определить поверхностную активность вещества по указанным данным.
|
№ |
Вещество |
s , мДж/м2 |
s (Н2О), мДж/м 2 |
Т, (К) |
С.ПАВ, моль/л |
|
231 |
CH3-CО-O-C2H5 уксусноэтиловый эфир |
68 |
71,96 |
298 |
15,6 |
|
232 |
CH3COOH уксусная кислота |
71,2 |
72,75 |
293 |
0,05 |
|
233 |
CH3-CH2-COOH пропионовая кислота |
67,7 |
72,75 |
293 |
0,05 |
|
234 |
CH3-CH2-COOH пропионовая кислота |
55,6 |
71,96 |
298 |
0,5 |
|
235 |
CH3-(CH2)3-COOH валерьяновая кислота |
52,1 |
75,62 |
273 |
0,5 |
|
236 |
CH3COOH уксусная кислота |
71, 2 |
72,75 |
293 |
0,125 |
237 - 240. Определить площадь занимаемую молекулой вещества (указанного в табл.) в насыщенном адсорбционном слое активированного угля.
|
№ |
Название вещества |
a ¥ - предельная адсорбция |
|
237 |
C3H7OH пропанол |
5,3 . 10 - 10 (моль/см2) |
|
238 |
CH3-CH-COOH изомасляная кислота | CH3 |
5,4 . 10 - 9 (кмоль/м2) |
|
239 |
C6H5NH2 анилин |
6,01 . 10 - 9 (кмоль/м2) |
|
240 |
C5H11OH пентанол |
5,3 . 10 – 10 (моль/см2) |
ЛИТЕРАТУРА
1. Краткий справочник физико-химических величин / Под. ред. А. А. Равделя и А.М. Пономаревой. Л.: Химия, 1983.
2. Д. Сталл, Э. Вестрам, Г. Зинке. Химическая термодинамика органических соединений. М.: Мир, 1971.
3. Физическая химия т.1, т. 2 / К.С. Краснов, Н.К. Воробьев, И. Н. Годнев и др. М.: Высшая школа, 1995.
4. И.В. Кудряшов, Г.С. Каретников «Сборник примеров и задач по физической химии»,1991, Москва, «Высшая школа».
5. Задачи по физической химии / В. В. Еремин, С. И. Каргов, И. А. Успенская и др. – М.: Изд-во «Экзамен», 2003. – 320 с.
6. Бадаев Ф. З., Батюк В. А. Цепные реакции. Москва, Изд-во МТГУ, 1995.
7. Химическая термодинамика. Методические указания. / Е. Е. Гончаренко, В. А. Батюк, Н. М. Елисеева и др. М.: Изд-во МГТУ, 1994.
