
- •1. Зависимость термодинамических функций от температуры
- •2. Фазовое равновесие в однокомпонентных системах
- •Зависимость теплоты фазового перехода от температуры описывается уравнением:
- •С учетом уравнения (21) уравнение (17) в интегральной форме принимает вид
- •3. Закон распределения. Экстракция Закон распределения выражается уравнением
- •4. Термодинамика растворов неэлектролитов
- •Для бинарного раствора парциальные давления компонентов AиBопределяются законом Рауля
- •Отсюда следует
- •Химический потенциал. Активность. Коэффициент активности
- •Коллигативные свойства растворов
- •5. Растворы сильных электролитов
- •6. Химическая кинетика сложных реакций
- •Для мономолекулярных обратимых реакций типа а в дифференциальная форма кинетического уравнения имеет вид
- •Считая концентрации n2o* и о.Стационарными, найти выражение для скорости распадаN2o.
- •7. Поверхностные явления. Адсорбция
- •Адсорбция на границе жидкость – газ
- •Содержание
- •2. Фазовое равновесие в однокомпонентных системах
- •4. Термодинамика растворов неэлектролитов
4. Термодинамика растворов неэлектролитов
Зависимость между давлением насыщенного пара данного компонента над раствором pi и его мольной долейx iустанавливается законом Рауля
![]() ,
,
где pi- давление насыщенного пара над чистым компонентом. Видеальныхрастворах закон Рауля выполняется для обоих компонентов во всем интервале составов.
Для бинарного раствора парциальные давления компонентов AиBопределяются законом Рауля
![]()
Общее давление пара над раствором
![]() ,
,
так как ![]() .
.
Соотношение между составом пара и жидкости в системах, подчиняющихся законам идеальных растворов, может быть выражено через давление насыщенных паров чистых компонентов и общее давление. Согласно закону Рауля и следствию из закона Дальтона
![]() .
.
Отсюда следует
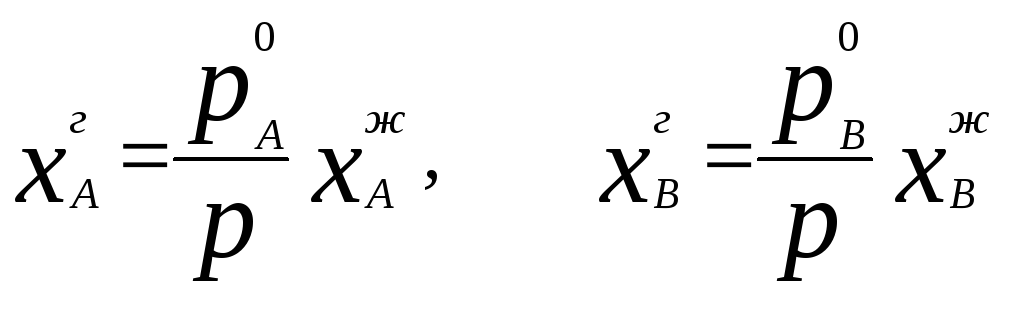 .
.
В реальных предельно разбавленныхрастворах для растворителя выполняется закон Рауля, а для растворенного вещества выполняетсязакон Генри:
![]() ,
,
где KГ- константа Генри.
Парциальные молярные величины
Парциальной молярной величиной(пмв) данного компонента называют частную производную от экстенсивного свойства раствора (g) по числу моль этого компонента
(ni ) при постоянстве температуры, давления и числа моль всех остальных компонентов:
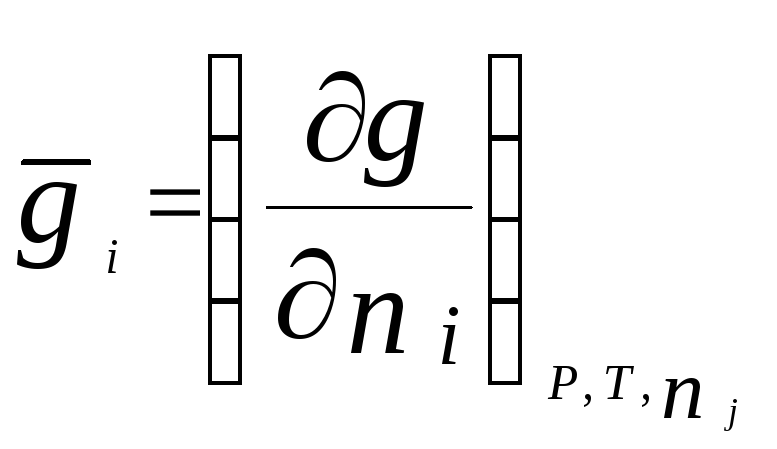 .
.
Парциальная молярная величина (![]() )i - го компонента
характеризует изменение данного
экстенсивного свойства раствора (g)
при добавлении 1 мольi– го компонента к столь большому
количеству раствора при постоянныхТиp, что добавление
этого количества компонента практически
не изменяет состава раствора.
)i - го компонента
характеризует изменение данного
экстенсивного свойства раствора (g)
при добавлении 1 мольi– го компонента к столь большому
количеству раствора при постоянныхТиp, что добавление
этого количества компонента практически
не изменяет состава раствора.
Общее значение свойства gвыражается суммой вкладов всех компонентов (первое уравнение Гиббса Дюгема):
![]() .
.
Парциальные молярные величины при постоянных риТсвязанывторым уравнением Гиббса Дюгема:
![]()
Химический потенциал. Активность. Коэффициент активности
Химический потенциал i- го компонента для идеальных растворов
определяется уравнением:![]() ,
,
где xi– молярная доляi - го компонента; i(T) – химический потенциал чистого компонента прир=1,013.105Па иxi = 1. В случае реального раствора
![]() ,
,
где ai– активностьi - го компонента. Активность данного компонента в реальном растворе определяется уравнением:
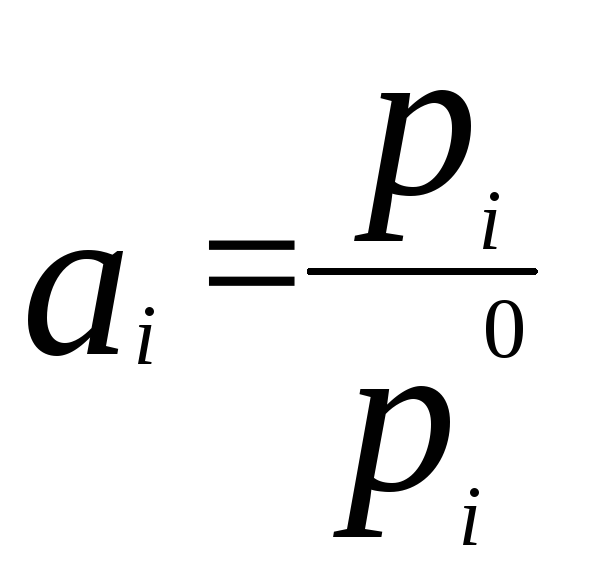 ,
,
где pi- давление насыщенного пара над чистым компонентом. Коэффициент активностиiравен
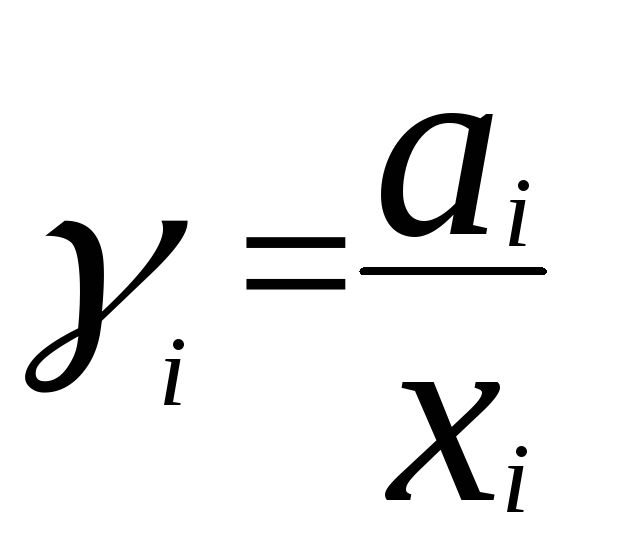 ,
,
где x i– мольная доляi- го компонента.
Коллигативные свойства растворов
Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся: понижение давления пара над раствором, повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем, осмотическое давление.
Повышение температуры кипения разбавленного раствора, содержащего нелетучее растворенное вещество, пропорционально моляльной концентрации этого вещества m:
![]() ,
,
где K Э - эбулиоскопическая константа растворителя:
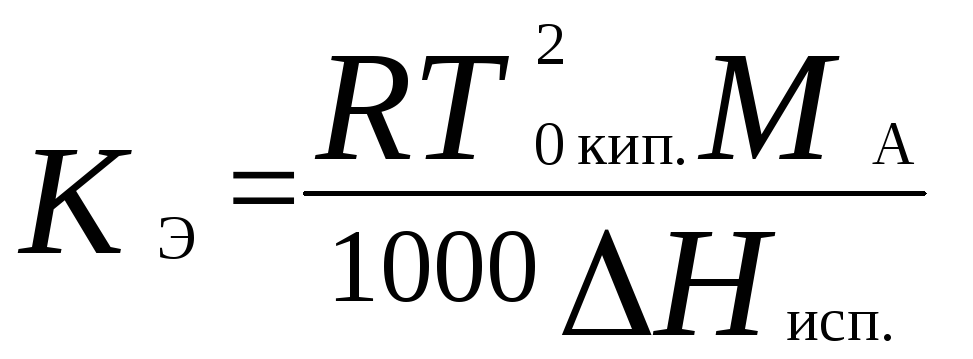 ,
,
Т0 кип.– температура кипения чистого растворителя,MA– молярная масса растворителя.
Для понижения температуры кристаллизации раствора справедливо следующее соотношение:
![]() ,
,
где K К – криоскопическая константа растворителя:
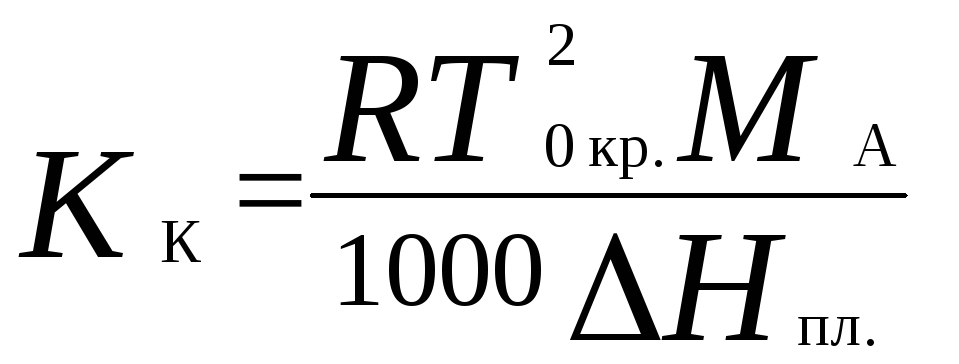 ,
,
Т 0кр.– температура кристаллизации чистого растворителя.
Осмотическое давление в разбавленных растворах можно рассчитать по уравнению
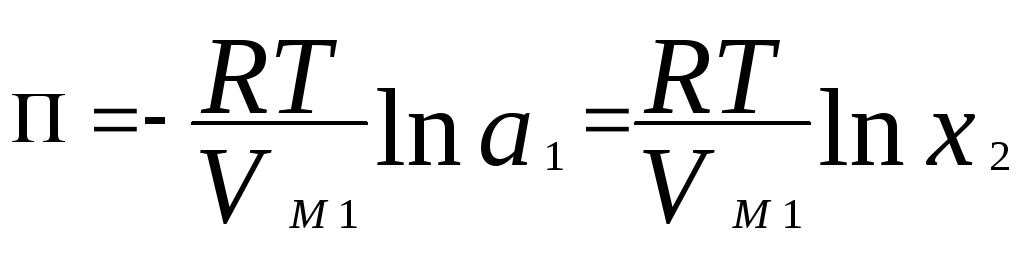 ,
,
где a1- активность растворителя,x2- молярная доля растворенного вещества,VM 1- молярный объем растворителя. Для очень разбавленных растворов это уравнение преобразуется в уравнение Вант-Гоффа:
= C R T ,
где С – молярная концентрация растворенного вещества.
Пример 10.Рассчитать состав раствора бензол – толуол в молярных долях, который при нормальном давлении кипит при температуре 1000С, а также состав образующегося пара. Раствор считать идеальным. Давления паров чистых бензола и толуола при 1000 С равны 179,987кПа и 74,126кПа соответственно.
Решение.Находим молярную долю бензола в растворе по закону Рауля:
p = p 02 + (p 01 – p 02 ) x 1 ,
где p- общее давление пара над раствором
101,32 = 74,126 + (179,987 – 74,126) x1, откудаx1 = 0,257 .
Молярная доля толуола в растворе равна x2 = 1 –x1= 0,743 .
Молярная доля бензола в паре равна:
y 1 = p 1/ p = x 1 p 01 / p = 0,257 . 179,987 / 101,32 = 0,456 .
Вычислим молярную долю толуола в паре: y 2 =1 –y 1 = 0,544 .
Пример 11. Плотность 20% водного раствора этилового спирта равна 0,97 г/см3при
Т= 298 К. Рассчитать парциальный молярный объем этилового спирта, если парциальный молярный объем воды равен 17,4 см3/ моль.
Решение.Находим число моль воды и этилового спирта в 100 г раствора:
n1= 80 / 18 = 4,44 ,n2 = 20 /46 = 0,43 .
ρ=m/V=100 /V, гдеV– объем раствора, откудаV=100 / 0,97 =103,09 см3.
Так как V=n1V1+n2 V2, находим парциальный мольный объем этилового спирта:
103,09 = 4,44 .17,04 + 0,43V2.
Откуда, V2= 60,07cм3.
Пример 12. 1) Вычислить активность и рациональный коэффициент активности ацетона С3Н6О в водном растворе, еслиx(С3Н6О) = 0,318;p(С3Н6О) = 152 Торр;p0 (С3Н6О) =
= 229 Торр. 2) Рассчитать химический потенциал μ (С3Н6О) , а также изменение химического потенциала Δ μ (С3Н6О) при растворении ацетона в воде.
Решение.a(С3Н6О) =p/p 0= 152 /229 = 0,664;
Так как a(С3Н6О) =x .γ,γ (С3Н6О) =a/x; γ(с3н6о) = 0,664 / 0,318 = 2,09 .
Так как γ больше единицы, отклонения от закона Рауля положительные.
2)Δ μ(С3Н6О) =RT lna(С3Н6О) = 8,31• 298• (ln0,664).10– 3= - 1,014 кДж / моль .
Так как μ 0(С3Н6О) = Δf G0298 (С3Н6О) = - 155,50 кДж / моль,
μ (С3Н6О) = Δμ (С3Н6О) +μ0 (С3Н6О) = - 1,014 + (- 155,50) = - 156,514 кДж / моль .
Задачи
88. Парциальные молярные объемы воды и метанола в растворе с молярной долей метанола 0,4 равны 17,35 и 39,01 см 3 / моль соответственно. Рассчитать объем раствора, содержащего 0,4 моль метанола и 0,6 моль воды, а также объем до смешения. Плотности воды и метанола равны 0,998 и 0,791 г / см3.
89. Парциальные молярные объемы воды и этанола в растворе с молярной долей этанола 0,2 равны 17,9 и 55,0 см 3 / моль соответственно. Рассчитать объемы воды и этанола, необходимые для приготовления 1 л такого раствора. Плотности воды и метанола равны 0,998 и
0,789 г / см 3.
90. Парциальные молярные объемы ацетона и хлороформа в растворе с молярной долей хлороформа 0,47 равны 74,17 и 80,24 см 3 / моль соответственно. Рассчитать объем такого раствора, имеющего массу 1 кг.
91. Плотность 50 % (масс.) раствора этанола в воде при 25 0С равна 0,914 г / см3 . Рассчитать парциальный молярный объем этанола в этом растворе, если парциальный молярный объем воды равен 17,4 см3/ моль.
92. Раствор, содержащий 60 % (масс.) метанола в воде, имеет плотность 0,895 г /см3 при
20 0С. Парциальный молярный объем воды в растворе этого состава равен 16,8 см3. Рассчитать парциальный молярный объем метанола.
93. Парциальные молярные объемы воды и метанола в растворе с молярной долей метанола 0,4 равны 17,35 и 39,01 см 3 / моль соответственно. Рассчитать объемы воды и метанола, необходимые для приготовления 300 мл такого раствора. Плотности воды и метанола равны 0,998 и 0,791 г / см3.
94. Давления пара чистых СНCl3 иCCl4при 250С равны 26,54 и 15,27 кПа. Предполагая, что они образуют идеальный раствор, рассчитать давление пара и состав (в молярных долях) пара над раствором, состоящим из 1 моль СНCl3 и 1 мольCCl4.
95. При 80 0С давление пара дибромэтилена равно 22,9 кПа, а дибромпропилена 16,9 кПа. Считая, что дибромэтилен и дибромпропилен при смешении образуют идеальные растворы, рассчитайте состав пара, находящегося в равновесии с раствором, молярная доля дибромэтилена в котором равна 0,75. Рассчитать состав раствора, находящегося в равновесии с паром, мольная доля дибромэтилена в котором равна 0,50.
96. При 20 0С давление пара этанола равно 5,93 кПа, а метанола - 11,83 кПа. Считая, что этанол и метанол при смешении образуют идеальные растворы, рассчитайте давление пара раствора, состоящего из 100 г этанола и 100 г метанола, а также состав (в молярных долях) пара над этим раствором при 200С.
97. Давление пара чистых бензола и толуола при 60 0С равны 51,3 и 18,5 кПа соответственно. Определите при каком давлении при 600С закипит раствор, состоящий из 1 моль бензола и 2 моль толуола. Определите состав пара (в молярных долях).
98. При 90 0С давление насыщенного пара толуола равно 53328,93 Па, а о – ксилола – 19998,35 Па. Считая этот раствор идеальным, определите состав жидкой смеси в молярных долях, которая будет кипеть при 900С, если давление насыщенного пара смеси при этом равно 50662,5 Па. Определите состав образующегося пара (в молярных долях).
99. При 600С давление насыщенного пара этанола равно 47022,8 Па, а давление насыщенного пара метанола – 83326,5 Па. Смесь этих спиртов, которую можно считать идеальной, содержит 50 % (масс.) каждого компонента. Определите состав пара над этим раствором при 600С.
100. Давление насыщенного пара над хлористым метилом при 273 К равно 2,64 .105Па, а над хлористым этилом при той же температуре – 0,638.105Па. Считая, что раствор хлористого этила в хлористом метиле подчиняется закону Рауля, определите состав пара (в молярных долях) над 50 % (масс.) раствором.
101. Давление пара чистых хлорбензола и бромбензола при 140 0С равны 1,237.105кПа и 0,658.105Па соответственно. Рассчитайте состав раствора хлорбензол – бромбензол, который при давлении 105Па кипит при температуре 1400С, а также состав образующегося пара.
102. Бензол и толуол образуют растворы, близкие по свойствам к идеальному. При
Т= 293 К давления паров бензола и толуола равны соответственно 1,020.104 Па и
0,327 .104 Па. Построить график зависимости содержания бензола в паре от содержания бензола в жидкой фазе. Определить содержание бензола в паре, если в жидкой фазе его содержится 40%.
103. Приняв, что SnCl4иCCl4образуют идеальный раствор, определить изменения энтропии и энергии Гиббса при образовании 0,5 кг раствора, в котором молярные доли компонентов равны 0,5 приТ= 298 К.
104. Давления паров веществ А и В соответственно равны 0,45 .105Па и 1,013.105Па. Определить состав пара над раствором, полученным смешением 0,5 моль А и 0,7 моль В, если компоненты образуют идеальный раствор.
105. Константа Генри для СО 2в воде при 250С равна 1666,4.105Па. Рассчитайте растворимость (в единицах моляльности) СО2в воде при 250С, если парциальное давление СО2над водой равно 0,1 атм.
106. Константы Генри для кислорода и азота в воде при 25 0С равны 4,40.109 и
8,68 .109 Па соответственно. Рассчитайте концентрации (в моляльностях) растворенных в воде кислорода и азота при 250С, если содержание в воздухе над водой азота 78,2 % и кислорода 20,9 % по объему, а его давление равно 105 Па.
107. Бензол и толуол образуют растворы, близкие по свойствам к идеальному. Давление пара чистых бензола и толуола при 60 0С равны 51,3 и 18,5 кПа соответственно. Построить график зависимости содержания бензола в паре от содержания бензола в жидкой фазе. Определить содержание бензола в паре, если в жидкой фазе его содержится 30%.
108. Хлороформ СНCl3и тетрахлорид углеродаCCl4образуют растворы, близкие по свойствам к идеальному. Давления пара чистых СНCl3 иCCl4при 250С равны 26,54 и 15,27 кПа соответственно. Построить график зависимости содержания хлороформа в паре от содержания хлороформа в жидкой фазе. Определить содержание хлороформа в паре, если в жидкой фазе его содержится 40%.
109. Этанол и метанол образуют растворы, близкие по свойствам к идеальному. При 20 0С давление пара этанола равно 5,93 кПа, а метанола - 11,83 кПа. Построить график зависимости содержания этанола в паре от содержания этанола в жидкой фазе. Определить содержание этанола в паре, если в жидкой фазе его содержится 60 %.
110. Дибромэтилен и дибромпропилен образуют растворы, близкие по свойствам к идеальному. При 80 0С давление пара дибпромэтилена равно 22,9 кПа, а дибромпропилена
16,9 кПа. Построить график зависимости содержания дибромэтилена в паре от содержания дибромэтилена в жидкой фазе. Определить содержание дибромэтилена в паре, если в жидкой фазе его молярная доля 0,45.
111. Давления паров веществ А и В соответственно равны 0,45 .105Па и 1,013.105Па. Определить состав пара над раствором, полученным смешением 0,3 моль А и 0,5 моль В, если компоненты образуют идеальный раствор.
112. При Т= 308 К давление пара ацетона 0,459.105 Па, а давление пара хлороформа
0,391 .105Па. Над раствором, содержащим 36 % хлороформа, парциальное давление паров ацетона равно 0,2677.105Па, а хлороформа 0,0964.105Па. Определить активности компонентов, а также коэффициенты активности.
113. Рассчитать активности и рациональные коэффициенты активности компонентов в растворе вода (1) – пропанол-1 (2), в котором мольная доля пропанола равна x2= 0,3, парциальные давления компонентов над раствором равны: p(H2O) = 3,84.10 3 Па, p(C3H7OH) =
= 2,53 .103 Па. Давления паров над чистыми компонентами равны: p0(H2O) = 4,24.103 Па;
p 0(C3H7OH) = 3,8 .10 3 Па. Вычислить изменение химического потенциала и химический потенциал при растворении компонента 2 в компоненте 1 ( 2 - 20). При расчете принять, что
0 =f G0 298 (чистого компонента). Недостающие данные взять из справочника.
114. При температуре 57,2 0С и давлении 1 атм молярная доля ацетона в паре над раствором ацетон – метанол с молярной долей ацетона в раствореxA= 0,400 равнаyA= 0,516. Рассчитать активности и рациональные коэффициенты активности обоих компонентов в этом растворе, используя закон Рауля. Давления паров чистых ацетона и метанола при этой температуре равны 756 и 551 Торр соответственно.
115. Для раствора этанол – хлороформ при 35 0С получены следующие данные:
|
xэтанола(р-р) |
0 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
yэтанола(пар) |
0 |
0,1382 |
0,1864 |
0,2554 |
0,4246 |
1,0000 |
|
pобщее, кПа |
39,345 |
40,559 |
38,690 |
34,387 |
25,357 |
13,703 |
Рассчитать коэффициенты активности обоих компонентов, используя закон Рауля.
116. Для раствора сероуглерод – ацетон при 35,2 0С получены следующие данные:
|
x(CS2)(р-р) |
0 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
p (CS2), кПа |
0 |
37,3 |
50,4 |
56,7 |
61,3 |
68,3 |
|
pацетона, кПа |
45,9 |
38,7 |
34,0 |
30,7 |
25,3 |
0 |
Рассчитать коэффициенты активности обоих компонентов, используя закон Рауля.
117. Экспериментально определены значения парциальных давлений над системой ацетон хлороформ приТ= 308,2 К в зависимости от состава:
|
x(CHCl3) |
0 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
p(CHCl3).10 – 4 Па |
0 |
0,453 |
1,093 |
1,973 |
3,00 |
3,906 |
|
p [(CH3)2 CO] . 10 – 4 Па |
4,586 |
3,600 |
2,440 |
1,360 |
0,560 |
0 |
На основании этих данных построить график зависимости парциальных и общего давлений над системой от состава. Сравнить с графиком для идеальной системы. Определить, при каком общем давлении закипит смесь, содержащая 50% хлороформа при Т= 308,2 К. Найти состав смеси, которая будет кипеть приp= 3,5.104 Па.
118. Температура кипения чистого бензола 353,1 К. Удельная теплота испарения при температуре кипения равна 399,69 кДж/кг. Раствор содержащий 0,0128 кг нафталина в 1 кг бензола. Определить: а) температуру кипения этого раствора; б) давление пара бензола над этим раствором, если давление насыщенного пара над чистым бензолом равно 2,433 .104Па.
119. Водный раствор, содержащий нелетучее растворенное вещество, кристаллизуется при 271,5 К. Определить температуру кипения раствора и давление пара над раствором при 298 К. Криоскопическая константа воды равна 1,86, эбулиоскопическая – 0,513. Давление насыщенного пара над чистой водой при 298 К равно 3167,21 Па.
120. При растворении 0,006 кг некоторого вещества в 0,25 кг воды температура кипения повысилась на 0,204 К . При растворении 0,003 кг этого вещества в 0,2 кг бензола температура кипения повысилась на 0,668 K. Найти эбулиоскопическую константу бензола, если эбулиоскопическая константа воды равна 0,513.
121. В 1 кг воды растворено 0,0684 кг сахара (М= 342 г / моль). Чему равно давление насыщенного пара над этом раствором приТ= 293 К, если давление насыщенного пара над чистой водой при 293 К равна 2338,5 Па? Чему равна температура кипения раствора, если для водыНисп. = 2256,7.103Дж/кг при температуре кипения?
122. Чистый кадмий затвердевает при Т= 594 К, 10%-ый раствор висмута в кадмии – приТ= 583 К. Определить энтальпию плавления кадмия.
123. Температура кристаллизации разбавленного раствора тростникового сахара
272,171 К. Давление насыщенного пара над чистой водой при этой температуре 568,6 Па, а скрытая теплота плавления льда 602,9 .104Дж/кмоль. Вычислить давление пара над раствором.
124. 68,4 г сахарозы (М= 342 г / моль) растворено в 1000 г воды. Рассчитайте: а) давление пара; б) температуру кристаллизации; в) температуру кипения; г) осмотическое давление раствора. Давление пара чистой воды при 200С равно 2338,5 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1,86 и 0,52 К.кг / моль соответственно.
125. Некоторое количество вещества, растворенное в 100 г бензола, понижает температуру его кристаллизации на 1,28 0. То же количество вещества, растворенное в 100 г воды, понижает температуру его кристаллизации на 1,3950. Вещество находится в бензоле в молекулярной форме, а в воде полностью диссоциировано. Определить, на сколько ионов вещество диссоциирует в водном растворе. Криоскопические постоянные для бензола и воды равны 5,12 и 1,86 К.кг / моль соответственно.
126. Используя справочные данные по давлению насыщенного пара воды при 250С и значению давления паров водного раствора глицерина, равному при этой температуре 3157,06 Па, вычислить осмотическое давление этого раствора при 370С. Плотность раствора равна 1,0017 г / см3. Молярная масса глицерина равна 92,09 г / моль.
127. Компоненты А и В образуют идеальный раствор. Давление пара чистого А при 25 0С равно 100 Торр. Давление пара чистого В при данной температуре практически равно нулю. Давление пара раствора, содержащего 10г А и 1г В при 250С равно 95 Торр. Найти отношение молярных масс А и В.
