
- •1. Зависимость термодинамических функций от температуры
- •2. Фазовое равновесие в однокомпонентных системах
- •Зависимость теплоты фазового перехода от температуры описывается уравнением:
- •С учетом уравнения (21) уравнение (17) в интегральной форме принимает вид
- •3. Закон распределения. Экстракция Закон распределения выражается уравнением
- •4. Термодинамика растворов неэлектролитов
- •Для бинарного раствора парциальные давления компонентов AиBопределяются законом Рауля
- •Отсюда следует
- •Химический потенциал. Активность. Коэффициент активности
- •Коллигативные свойства растворов
- •5. Растворы сильных электролитов
- •6. Химическая кинетика сложных реакций
- •Для мономолекулярных обратимых реакций типа а в дифференциальная форма кинетического уравнения имеет вид
- •Считая концентрации n2o* и о.Стационарными, найти выражение для скорости распадаN2o.
- •7. Поверхностные явления. Адсорбция
- •Адсорбция на границе жидкость – газ
- •Содержание
- •2. Фазовое равновесие в однокомпонентных системах
- •4. Термодинамика растворов неэлектролитов
Московский государственный технический университет им. Н. Э. Баумана
Методические указания к решению задач домашнего задания
по курсу «Физическая и коллоидная химия»
Москва 2005
1. Зависимость термодинамических функций от температуры
Расчет стандартной энтальпии r H 298 реакции: 1А1 + 2А2 = 3 A3 + 4 А4,
производится следующим образом:
![]() ,
(1)
,
(1)
где f H 298 (А i ) – стандартная энтальпия образования вещества. Если химический процесс протекает при стандартных условиях и данной температуре Т, изменение энтальпии r H 0T в результате реакции рассчитывается по уравнению Кирхгофа в интегральной форме
![]() ,
,
![]() где
С P
- алгебраическая сумма теплоемкостей
веществ:
где
С P
- алгебраическая сумма теплоемкостей
веществ:
![]() . (3)
. (3)
Температурная зависимость теплоемкостей веществ при Т 200 К представляется в виде ряда:
![]() .
.
Тогда уравнение (3) примет вид
![]() ,(4)
,(4)
где
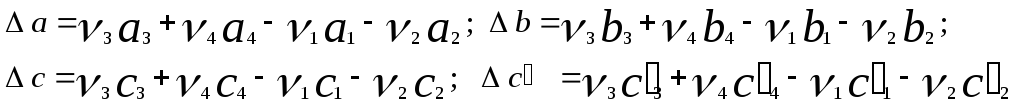
С учетом температурных рядов для теплоемкостей веществ расчет rH 0T производится по формуле:
![]() . (5)
. (5)
Для упрощения расчета теплового эффекта объединим величину r Н º298 и все слагаемые в уравнении (5), содержащие множитель 298, в одно:
r
Н
º298-a298 -![]() 2982 +c
2982 +c![]() -
- ![]() 2983=r
Н
. (6)
2983=r
Н
. (6)
Подставив в уравнение (5) величину r Н из (6), получим:
r
Н
ºТ=r
Н
+a
Т+![]() T2-c
T2-c![]() +
+![]() Т3 , (7)
Т3 , (7)
где r Н – эмпирическая постоянная для данной реакции, размерность которой совпадает с размерностью теплового эффекта.
Пример 1. Получить выражениеr Н ºТ=T) и вычислитьr Н º1000для реакции
СН4 (г)+ 2Н2О(г)= СО2 (г)+ 4Н2 (г).
Решение.В соответствии с уравнением (6) сначала вычисляем тепловой эффект реакцииr Н º298и алгебраические суммыa,b,cПользуясь справочником [1], находим:r Н º298= 4f Н º298(Н2) +f Н º298(СО2) -f Н º298(СН4) – 2f Н º298(Н2О) =
= 4 .0 + (- 393,51) – 74,85 – 2.(- 241,84) = 165,02 кДж/моль,
С рº (СО2) = 44,14 + 9,04·10 – 3 Т + 8,53 ·10 5 · Т - 2 ,
С рº (Н2) = 27,28 + 3,26·10 – 3 Т + 0,502·10 5 Т – 2,
С рº (Н2О) = 30 + 10,71·10 - 3 Т + 0,33·10 5 Т – 2,
С рº (СН4) = 17,45 + 60,46·10 – 3 Т + 1,117 ·10 - 6 · Т 2 .
Отсюда получаем a= 44,14 + 4.27,28 – 2· 30– 17,45 = 75,81 Дж/(моль.K).
Аналогично вычисляем: b= - 59,8·10- 3Дж/(моль·K 2 ),c= 9,87·105Дж·K/моль,
c·10 – 6 Дж / (моль . К 3).
Подставив вычисленные величины r Н º298,a,b,c,cв уравнение (6), получим
r Н = 148406,24 Дж/моль. В соответствии с (7) будем иметь выражение, удобное для расчетов в широком интервале температур:
r Н 0 Т= 148406,24 + 75,81Т- 29,905·10– 3 Т2- 9,87·105 Т– 1 – 0,37.10- 6.
Затем из полученного уравнения r Н ºТ=T) вычисляем:
r Н º1000= 192959,24 Дж/моль = 192,96 кДж /моль.
Расчет теплового эффекта по уравнению Кирхгофа (7) с использованием температурных рядов для теплоемкостей является относительно трудоемким. Вычисление теплового эффекта реакции по уравнению Кирхгофа (2) значительно упрощается, если для приближенных расчетов воспользоваться вместо температурных рядов стандартными теплоемкостями веществ (C0p 298). Подставляя в уравнение (2) вместоСр величину:
![]() , (8)
, (8)
после интегрирования от 298 до Тполучим:r Н ºТ=r Н º 298+ C0p 298(Т- 298) , (9)
где С0р(Аi) – стандартная теплоемкостьi-го вещества.
Пример 2. Рассчитать тепловой эффектr Н º Треакции
СН4 (г)+ 2Н2О(г)= СО2 (г)+ 4Н2 (г) при 1000 К, используя стандартные теплоемкости веществ.
Решение. Пользуясь справочником [1], находим стандартные теплоемкости веществ:
С 0р 298(СО2) = 45,52 Дж/(моль·К),С 0р 298(Н2) = 29,28 Дж/(моль·К),
С 0р 298 (Н2О) = 36,02 Дж/(моль·К),С 0р 298 (СН4) = 49,52 Дж/(моль·К).
По уравнению (8) вычисляем:
C0p 298= 45,52 + 4 . 29,28 – 2· 36,02 - 49,52 = 41,08 Дж/(моль·К) .
Для исследуемой реакции r Н º 298= 165020 Дж/моль. В соответствии с (9):
r Н º1000= 165020 + 41,08.(1000 - 298) = - 56236 Дж/моль = 193858,16 Дж /моль.
Расхождение между величинами теплового эффекта, вычисленными по уравнениям (7) и (9), менее 1%.
Третий метод вычисления теплового эффекта реакции при Т> 298 К основан на использовании табличных данных для теплот образованияf Н º (298) и высокотемпературных составляющих [Н º T–Н º 298] участников реакции. Выражение для расчетаr Н º Т=T) выглядит так:
r Н º T=r Н º 298+r [Н º T–Н º 298]. (10)
Стандартный тепловой эффект реакции вычисляют по 1-ому или 2-ому следствиям закона Гесса. Второе слагаемое в уравнении (10) определяется из соотношения:
r[Н ºT–Н º298]= 3 [Н ºT–Н º298]А3 + 4 [Н ºT–Н º298] А4 –
1[Н ºT–Н º298] А1 - 2 [Н ºT–Н º298]А2 . (11)
Пример 3. Вычислить тепловой эффект реакции: СН4 (г)+ 2Н2О(г)= СО2 (г)+ 4Н2 (г) при 1000 К.
Решение.По уравнению (11) определяем:
r [Н ºT–Н º298]= [Н ºT–Н º298]СО2+ 4 [Н ºT–Н º298]H2 –[Н ºT–Н º298]СН4
– 2 [Н ºT–Н º298]H2О .
По табличным данным для [Н ºT–Н º298] для веществ (см. [2]), находим:
r [Н ºT–Н º298] = 33388,3 + 4.20677,3 – 38492,8 – 2·26024,5 = 25555,7 Дж/моль.
Для исследуемой реакции r H º298 = 165020 Дж/моль (см. пример 1). По уравнению (10) вычисляем: r H º 1000 = 165020 + 25555,7 = 190575,7 Дж/моль = 190,6 кДж/моль.
Изменение энтропии при обратимом процессе определяется уравнением:
![]() .
.
Если система нагревается от температуры Т1доТ2при постоянном давлении, то
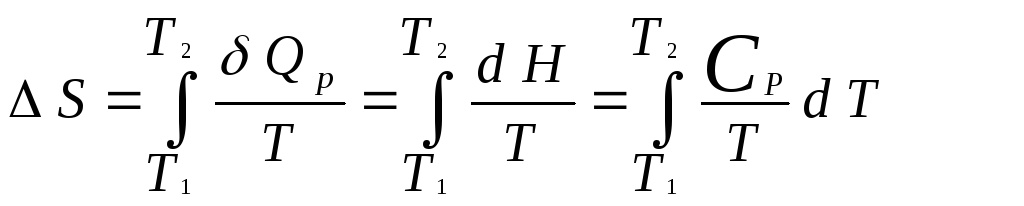 . (12)
. (12)
Изменение энтропии при изотермических процессах, в частности при фазовых превращениях, определяется уравнением:
![]() . (13)
. (13)
Уравнения (12) и (13) дают возможность рассчитать изменение энтропии в результате изобарного перехода любого вещества из твердого состояния при исходной температуре Т1в парообразное при конечной температуреТ2:
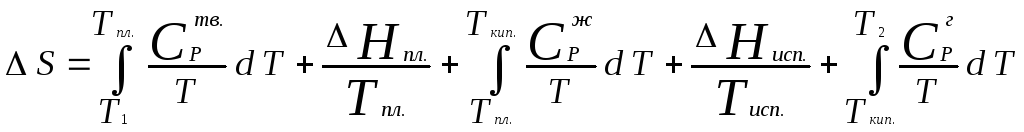 .
.
Расчет стандартной энтропии реакции rS298производится по формуле:
![]() ,
,
где S298(Ai)– стандартная абсолютная энтропия вещества; i– коэффициенты в уравнении реакции. Изменение энтропии в результате реакцииrSTпри стандартных условиях и данной температуреТвычисляется с учетом зависимостей теплоемкостей веществ от температуры:
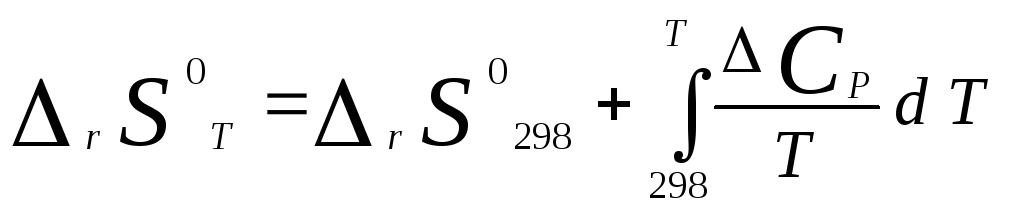 , (14)
, (14)
где С ропределяется уравнением (4). Если теплоемкости веществ задаются температурными рядами, тогда изменение энтропии для химической реакции равно:
![]() .
.
Расчет стандартной энергии Гиббса и константы равновесия
по методу Темкина – Шварцмана
Изменение стандартной энергии Гиббса в результате реакции равно
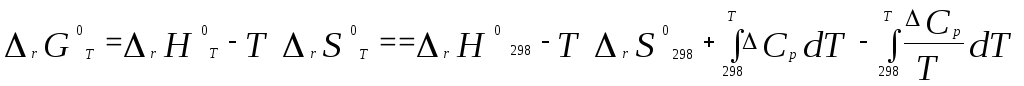 .
(15)
.
(15)
С учетом того, что C pопределяется уравнением (4), уравнение (15) можно преобразовать в форму, удобную для расчета:
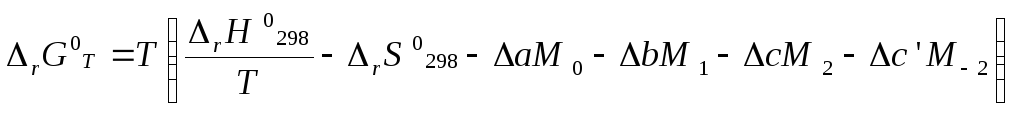 ,
,
где
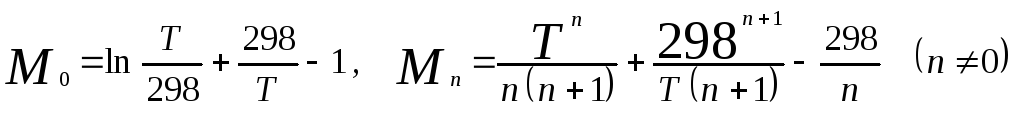 .
.
Коэффициенты M0,M1,…,Mnприведены в справочнике [1]. Логарифм константы равновесия равен
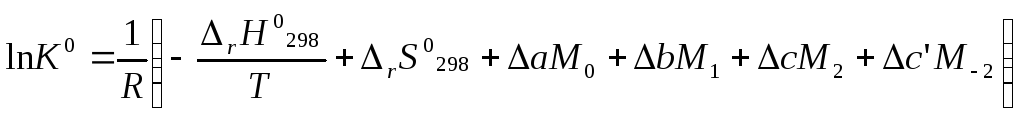 . (16)
. (16)
Пример 4. ОпределитьК 0 при 900 К для реакции СН4 (г)+ 2Н2О(г)= СО2 (г)+ 4Н2 (г).
Решение.Пользуясь справочником [1], находим
r H º298= 165020 Дж/моль;
r S 0 298 = S 0 298 (CO2) + 4 S 0 298 (Н2) - S 0 298 (CН4) – 2 S 0 298 (Н2О) =
= 213,66 + 4130,52 – 186,272188,72 = 172,33 Дж / К;
При 900 К величины Mnимеют следующее значение:M0 = 0,4361;M1 = 0,2012103;
M2 = 0,1004106 ;M– 2 = 0,252110- 5.
Подставляя эти значения в уравнение (16) и используя результаты, полученные в примере 1, получаем
ln
K 0
(900) =![]() [ -
[ -![]() + 172,33 + 75,81.
0,4361 + (- 59,81.10– 3).0,2012.103+
+ 172,33 + 75,81.
0,4361 + (- 59,81.10– 3).0,2012.103+
+ (- 1,117 .10– 6).0,1004.106+ 9,87.105. 0,2521.10– 5] = 1,49;
K0(900) = 4,4.
Расчет изменения стандартной энергии Гиббса и константы равновесия
с помощью функций приведенных энергий Гиббса веществ
Под стандартной приведенной энергией Гиббса, или стандартным приведенным термодинамическим потенциалом, понимают функцию
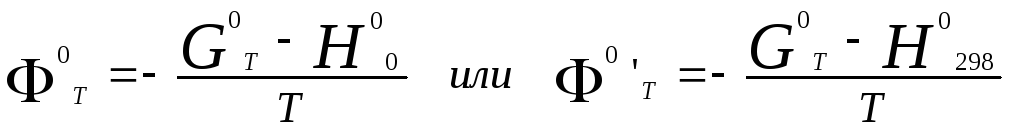
где G T- стандартное значение энергии Гиббса при температуреТ;H 0иH 298– стандартные значения энтальпии при 0 и 298 К соответственно.
Стандартная энергия Гиббса равна
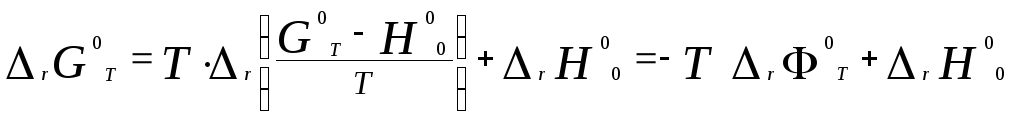 ,
,
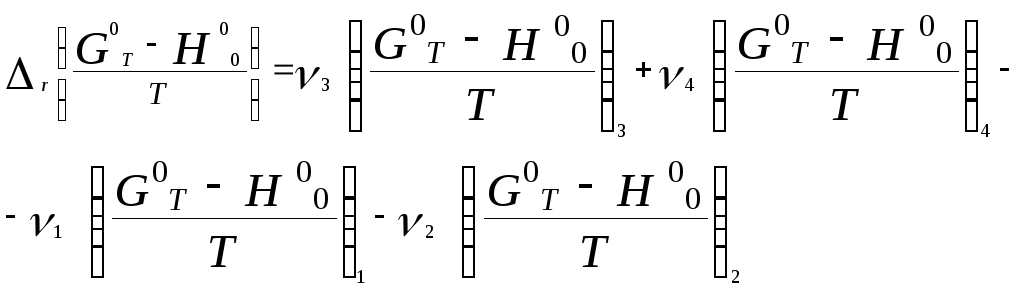
Логарифм стандартной константы равновесия реакции равен
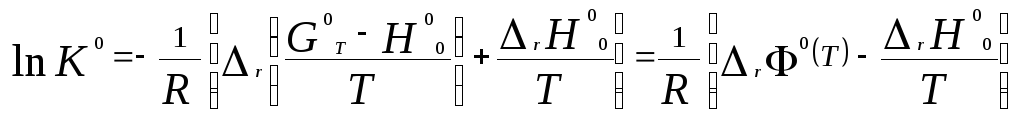 .
.
Для температуры 298 К эта формула имеет вид:
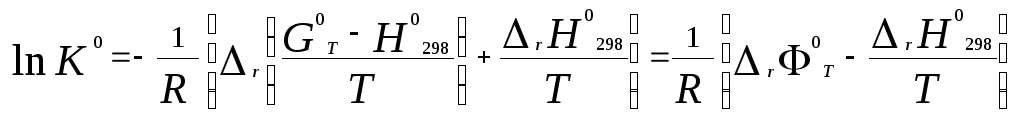 .
.
Е![]() сли
стандартные энтальпии образования
веществ при 0 К отсутствуют, то вычислениеrH 00можно осуществить на основании
табличных данных для стандартных
энтальпий образованияf
H 0298и высокотемпературных
составляющих энтальпий [H 0T–H 0298] при 298 К для каждого
реагента:
сли
стандартные энтальпии образования
веществ при 0 К отсутствуют, то вычислениеrH 00можно осуществить на основании
табличных данных для стандартных
энтальпий образованияf
H 0298и высокотемпературных
составляющих энтальпий [H 0T–H 0298] при 298 К для каждого
реагента:
![]()
Задачи
В задачах №№ 1 – 45 для данных химических реакций выполните следующие задания (необходимые данные возьмите из справочника):
1. Учитывая зависимости теплоемкостей веществ от температуры, вычислите значения
rH0Tв интервале температур 300 – 1000 К с шагом 100K. Выразите уравнением зависимостьrH0T от температуры. Постройте график зависимостиrH0T=f (T).
2. Используя значения стандартных теплоемкостей веществ C0p 298, рассчитайтеrH0Tпри температуреТ. Сравните значенияrH0Tдля этой температуры, рассчитанные двумя методами.
3. Учитывая зависимости теплоемкостей веществ от температуры, вычислите значения
rS0Tв интервале температур 300 – 1000К с шагом 100K. Постройте график зависимости
r S 0T = f (T).
4. Вычислите значения rG0Tв интервале температур 300 – 1000 К с шагом 100Kпо методу ТемкинаШварцмана. Постройте график зависимостиrG0T=f (T).
5. Рассчитайте значение константы равновесия К0(Т) при температуреТ, пользуясь методом ТемкинаШварцмана.
6. Используя значения функций приведенной энергии Гиббса 0Tи0Tопределить константу равновесия при температуреТ. Сравните результаты расчетов двумя методами.
7. Проанализируйте результаты термодинамических расчетов и определите, каким образом можно уменьшить выход экологически вредных продуктов реакции. При каких условиях следует проводить процесс?
|
№ задачи |
Реакции |
Т, K |
|
1 |
0,5 H2 (г) + 0,5Br2 (г) =HBr(г) |
700 |
|
2 |
0,5 CH4 (г) + 0, 5CO2 (г) =CO(г)+ 2H2 (г) |
900 |
|
3 |
C2H6 (г) =C2H4 (г) +H2 (г) |
1000 |
|
4 |
NO (г)+ 1,5 H2O(г)= NH3(г)+ 1,25O2(г) |
400 |
|
5 |
NO2 (г)= NO(г)+ 0,5 O2 (г) |
1000 |
|
6 |
CO(г)+Cl2 (г) =COCl2 (г) |
500 |
|
7 |
CH4 (г)+ 0,5O2 (г)=CH3OH(г) |
400 |
|
8 |
CO(г)+ ½O2 (г) =CO2 (г) |
500 |
|
9 |
CO2 (г)+H2 (г) =HCOOH(г) |
400 |
|
10 |
СН4 (г)= 0,5 С2Н2(г) + 1,5 Н2 (г) |
1200 |
|
11 |
3H2 (г) +CO(г)=CH4 (г) +H2O(г) |
800 |
|
12 |
2CO(г)+ 3H2 (г) =C2H2 (г) + 2H2O(г) |
500 |
|
13 |
SO2 (г) + Cl2 (г) = SO2Cl2 (г) |
400 |
|
14 |
2NH3 (г) + 2O2 (г) =N2O(г)+ 3H2O(г) |
500 |
|
15 |
CO (г) +H2 (г) =HCOH (г) |
400 |
|
16 |
CO (г) + H2O(г)= CO2 (г) + H2 (г) |
600 |
|
17 |
NO (г) +H2O (г) =NO2(г)+H2 (г) |
800 |
|
18 |
C6H6 (г)+ 3H2 (г)= цикло -C6H12 (г) |
700 |
|
19 |
C2H2 (г) +N2 (г) = 2HCN(г) |
900 |
|
20 |
C (графит)+ 2Cl2 (г) = CCl4 (г) |
600 |
|
21 |
CS2 (г)+ 4H2 (г)= 2H2S(г) +CH4 (г) |
700 |
|
22 |
C (графит)+ 2H2 (г) = CH4 (г) |
800 |
|
23 |
CO (г)+ NO(г)= CO2 (г)+ 0,5N2 (г) |
1000 |
|
24 |
CCl4 (г)+ 2H2O(г)= CO2 (г)+ 4HCl(г) |
400 |
|
25 |
н-C4H10 (г) =C4H8 (г) +H2 (г) |
1000 |
|
26 |
CH4 (г)+ 2H2O(г)= CO2 (г)+ 4H2 (г) |
900 |
|
27 |
CH3CHO(г)+ H2 (г) = C2H5OH(г) |
800 |
|
28 |
C2H6 (г)+ CO(г)= CH3COCH3 (г)(ацетон) |
600 |
|
29 |
CH4 (г) +CH3Cl(г)=C2H6 (г) +HCl(г) |
600 |
|
30 |
NO (г)+ 2,5 H2 (г)= NH3 (г)+ H2O(г) |
800 |
|
31 |
CO2 (г)+ 2H2 (г)= HCHO(г)+ H2O(г) |
700 |
|
32 |
C2H4(г) =C2H2 (г)+H2 (г) |
1000 |
|
33 |
HCHO(г)+H2 (г) =CH3OH(г) |
800 |
|
34 |
CH3Cl(г)+ 2Cl2 (г) =CHCl3 (г) + 2HCl(г) |
600 |
|
35 |
CO2 (г)+ 3H2 (г)= CH3OH(г)+ H2O(г) |
500 |
|
36 |
CCl4 (г)+ H2O(г)= COCl2 (г)+ 2HCl(г) |
600 |
|
37 |
C2H5OH(г) = C2H4 (г) + H2O(г) |
800 |
|
38 |
C3H8 (г) =C3H6 (г) +H2 (г) |
1000 |
|
39 |
CO2 (г) + 4H2 (г) =CН4 (г) + 2H2O(г) |
500 |
|
40 |
C3H8 (г)=C2H4 (г)+CH4 (г) |
1000 |
|
41 |
CH3CHO(г)=CН4 (г) + СO(г) |
800 |
|
42 |
0,5 С2H4 (г)+ 1,5 O2 (г)= CO2 (г)+ H2O(г) |
600 |
|
43 |
2H2 (г) +CO(г)=CH3OH(г) |
500 |
|
44 |
2NO (г)+ 2H2 (г)= N2 (г)+ 2H2O(г) |
600 |
|
45 |
NO(г)+ 0,5Cl2(г)=NOCl(г) |
800 |
