
- •Занятие 13
- •Цель занятия
- •3. Гидроксид алюминия является лёгким аморфным осадком. Его оптимальная масса, как осаждаемой формы, при гравиметрическом определении составляет примерно:
- •4. При проведении гравиметрических определений методом осаждения навеску исходного вещества растворяют в воде (или другом растворителе) в таком соотношении, чтобы получился примерно:
- •5. Что из перечисленного неверно?
- •Предварительные расчёты
- •Занятие 14
- •Цель занятия
- •Результаты, полученные студентами первой группы
- •Занятие 15
- •Занятие 16
- •Цель занятия
- •2. Обратное титрование применяют, если:
- •3. В процессе косвенного титрования:
- •4. Согласно методике анализа Вам необходимо добавить к анализируемому раствору 10,00 мл стандартного раствора титранта. Какой мерной посудой Вы воспользуетесь?
- •5. Что из перечисленного неверно?
- •1. Проверка вместимости мерной колбы
- •2. Проверка вместимости пипетки
- •3. Проверка вместимости бюретки
- •Проверка вместимости бюретки
- •4. Определение объёма капли
- •Занятие 17
- •Цель занятия
- •9. Какие из перечисленных ниже индикаторов в водном растворе, имеющем рН 2, будут окрашены в красный цвет?
- •10. К 10 мл 0,1 м раствора вещества 0,1 моль/л добавляют 1 каплю 1% этанольного раствора фенолфталеина. В растворах каких веществ при этом произойдёт появление окраски?
- •1. Приготовление и стандартизация 0,1 м hCl
- •2. Приготовление и стандартизация 0,1 м koh
- •Занятие 18
- •Цель занятия
- •10. Что из перечисленного ниже неверно?
- •Цель занятия
- •Цель занятия
- •Занятие 21
- •Цель занятия
- •1. Приготовление и стандартизация 0,05 м эдта
- •2. Комплексонометрическое определение сульфата цинка
- •3. Комплексонометрическое определение хлорида кальция
- •Занятие 22
- •Цель занятия
- •1. Что из перечисленного верно?
- •1. Стандартизация 0,1м AgNo3
- •2. Аргентометрическое определение ki
- •Занятие 23
- •Цель занятия
- •3. Какая из перечисленных ниже формул принадлежит n-фенилантраниловой кислоте?
- •5. Редуктор Джонса:
- •10. Реактив к.Фишера представляет собой смесь:
- •1. Стандартизация раствора тиосульфата натрия
- •2. Иодометрическое определение пероксида водорода
- •Цель занятия
- •1. Какие из веществ, формулы которых приведены ниже, могут быть определены методом нитритометрического титрования на основе реакции диазотирования?
- •2. Что из перечисленного ниже верно?
- •1. Приготовление и стандартизация 0,1 м NaNo2
- •2. Нитритометрическое определение стрептоцида
- •Занятие 25
- •Цель занятия
- •1. Стандартизация 0,05 м 1/5kMnO4
- •2. Перманганатометрическое определение пероксида водорода
- •Занятие 26
- •Цель занятия
Цель занятия
Знать:
общую характеристику, титранты и стандартные вещества, условия выполнения и практическое применение хлориодометрического, иодатометрического и нитритометрического титрования.
Уметь:
проводить приготовление и стандартизацию раствора нитрита натрия;
выполнять количественное определение стрептоцида методом нитритометрического титрования.
Хлориодометрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение.
Иодатометрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение.
Нитритометрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение.
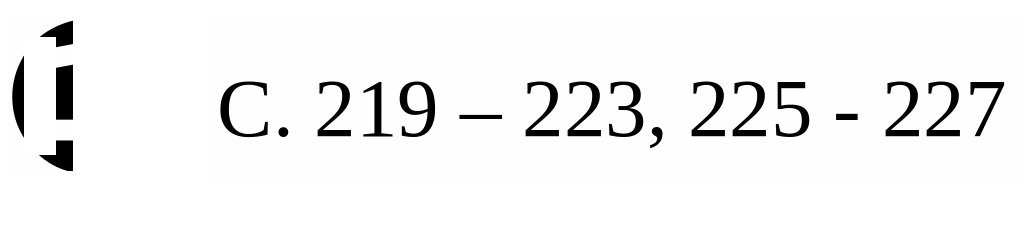
Титрование монохлоридом иода проводят в кислой или слабощелочной среде. Почему данный титрант не применяется для титрования в сильнощелочной среде?
При хлориодометрическом титровании некоторых веществ к титруемому раствору рекомендуют добавлять HgCl2, который связывает ионы I-. Каким образом это будет сказываться на окислительной способности монохлорида иода?
Приведите примеры хлориодометрических определений, основанных на реакции SE.
Что такое «иодное число»? Объясните принцип его определения методом хлориодометрического титрования.
Будет ли одинаковым фактор эквивалентности для KIO3 при его использовании в качестве титранта для определения аскорбиновой кислоты в слабокислой среде и гидразина в концентрированном растворе HCl? В лаборатории имеется 0,0200 М KIO3. Какой объём такого раствора потребуется для титрования 0,1 ммоль аскорбиновой кислоты в первом случае и 0,1 ммоль гидразина во втором?
Почему для обнаружения конечной точки иодатометрического определения гидразина, которое проводится в сильнокислой среде, нельзя применять крахмал? Как обнаруживают конечную точку такого титрования?
Почему нитритометрическое титрование, основанное на реакции диазотитрования, используется для определения ароматических аминов, а не алифатических? Как влияет рН на протекание этой реакции? Почему титрование желательно вести на холоду? Зачем к раствору добавляют бромид калия?
Приведите примеры нитритометрического определения лекарственных веществ, не основанного на реакции диазотирования.
Вещества, формулы которых приведены ниже, после проведения предварительных реакций также могут быть определены нитритометрически. Что это за реакции?

Почему в качестве внутреннего индикатора при нитритометрическом определении удобно использовать не один тропеолин 00, а его смесь с метиленовым синим?
1. Какие из веществ, формулы которых приведены ниже, могут быть определены методом нитритометрического титрования на основе реакции диазотирования?
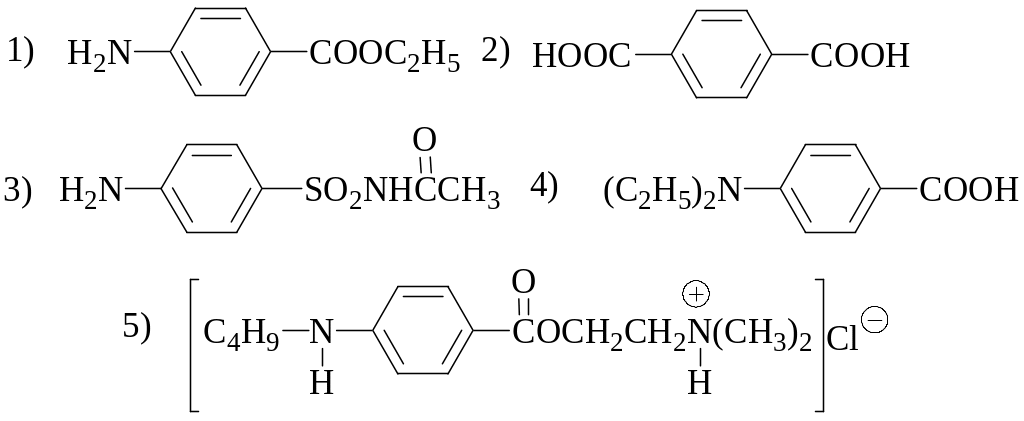
2. Что из перечисленного ниже верно?
стандартный раствор нитрита натрия, используемый в нитритометрическом титровании, является первичным;
для стандартизации раствора нитрита натрия используется 4-аминобензолсульфоновая кислота;
нитрит натрия и сульфаниловая кислота реагируют в молярном отношении 1:1;
реакция диазотирования протекает медленно, поэтому нитритометрическое титрование проводят при температуре не ниже 30 С;
в конечной точке нитритометрического титрования тропеолин 00 изменяет свою окраску от фиолетовой до голубой.
3. Какие из реагентов используются при нитритометрическом определении стрептоцида?
1) HCl; 2) NaNO2; 3) KBr; 4) KBrO3; 5) KOH
4. В качестве внешнего индикатора в нитритометрическом титровании используется:
бумага, пропитанная раствором тропеолина 00;
бумага, пропитанная раствором KI;
бумага, пропитанная раствором I2 и крахмала;
бумага, пропитанная раствором KI и крахмала;
бумага, пропитанная раствором крахмала.
5. Для получения монохлорида иода - титранта хлориодометрического титрования используется реакция:
I2 + Cl2 2ICl
3I2 + 2HNO3(конц) + 6HCl(конц) 6ICl + 2NO + 4H2O
I2Cl6 2ICl + Cl2
2KI + KIO3 + 6HCl 3ICl + 3KCl + 3H2O
2KI + KIO3 + 3KCl + 3H2O 3ICl + 6KOH
6. При встряхивании приготовленного стандартного раствора монохлорида иода с хлороформом слой последнего окрасился в фиолетовый цвет. Это указывает на то, что:
к раствору следует добавить KI;
к раствору следует добавить KIO3;
приготовленный раствор содержит только ICl и готов к дальнейшему использованию;
к раствору следует добавить I2;
к раствору следует добавить HCl.
7. При проведении хлориодометрического титрования:
определение обычно проводят в кислой, нейтральной или слабощелочной среде;
определение проводят только в сильнощелочной среде;
всегда проводят только обратное титрование;
в качестве индикатора используют крахмал;
точку конца титрования всегда обнаруживают по исчезновению окраски титранта.
8. Стандартный раствор иодата калия:
можно приготовить по точной навеске KIO3;
всегда является вторичным, так как KIO3 - гигроскопичное вещество и содержит примеси;
устойчив при хранении;
неустойчив при хранении, так как KIO3 легко окисляется кислородом воздуха;
может быть стандартизирован методом иодометрического титрования;
9. Иодатометрическое титрование:
проводится в кислой среде;
проводится в щелочной среде;
используется только для определения окислителей;
в случае определения аскорбиновой кислоты заканчивают при появлении синей окраски иодкрахмального комплекса;
в случае определения аскорбиновой кислоты заканчивают при исчезновении синей окраски иодкрахмального комплекса.
10. В процессе иодатометрического титрования одна молекула аскорбиновой кислоты теряет 2 электрона, при этом 1 моль аскорбиновой кислоты реагирует с:
1) 1 моль 1/6 KIO3; 2) 2 моль 1/6 KIO3; 3) 3 моль 1/6 KIO3
4) 1/4 моль KIO3; 5) 2/3 моль KIO3.
Навеску масла какао массой 0,5263 г поместили в сухую колбу с притёртой пробкой и растворили в 6 мл диэтилового эфира. К полученному раствору прибавили 25,00 мл раствора монохлорида иода. После взбалтывания содержимого колбы в течение 1 минуты к нему прибавили 10 мл 10% раствора KI, 50 мл воды. Для титрования выделившегося иода потребовалось 10,75 мл 0,1000 М Na2S2O3. Определите иодное число данного образца масла какао, если в контрольном опыте для титрования выделившегося иода потребовалось 25,30 мл 0,1000 М Na2S2O3.
Сущность методики определения иодного числа заключается в следующем. Вначале к исследуемому образцу органического соединения добавляют избыток раствора монохлорида иода. Через некоторое время, необходимое для протекания реакции иодирования, к реакционной смеси добавляют иодид калия, при этом протекает реакция
I+ + I- I2
Выделившийся иод титруют раствором тиосульфата натрия.
В контрольном опыте весь иод, входивший в состав монохлорида иода, переводится в I2 и затем титруется раствором тиосульфата. Разность между количеством тиосульфата натрия, вступившим в реакцию с иодом в контрольном опыте и в присутствии определяемого вещества, соответствует иоду, израсходованному для иодирования органического соединения. С учётом того, что одна формульная единица Na2S2O3 взаимодействует с 1/2I2, иодное число (I) анализируемого образца органического вещества, можно рассчитать по следующей формуле
![]()
В приведенном в условии задачи случае
![]() 35
35
Для титрования навески сульфаниловой кислоты (М = 173,19 г/моль) массой 0,1992 г было израсходовано 11,45 мл раствора нитрита натрия. Рассчитайте молярную концентрацию NaNO2 в стандартизируемом растворе и его титр по анестезину (этиловому эфиру п-аминобензойной кислоты, М = 165,19 г/моль). Ответ: 0,1005 моль/л, 1,66010-2 г/мл.
Навеску образца лекарственного вещества парацетамола /п-ацетиламинофенола/ (М = 151,2 г/моль) массой 0,2555 г гидролизовали в кислой среде. Для титрования полученного п-аминофенола было израсходовано 16,80 мл 0,1000 М NaNO2. Рассчитайте массовую долю парацетамола в образце. Ответ: 99,42%.
Рассчитайте массу KI и KIO3 необходимых для приготовления 1 л 0,1 М 1/2 ICl. Ответ: 5,53 г и 3,55 г.
Навеску миндального масла массой 0,1053 г поместили в колбу вместимостью 250 мл и растворили в 3 мл диэтилового эфира. К полученному раствору прибавили 25,00 мл 0,1000 М 1/2 ICl. После взбалтывания в течение 1 минуты к содержимому колбы добавили 10 мл 10% раствора KI, 50 мл воды и оттитровали выделившийся иод 17,10 мл 0,1000 М Na2S2O3. Определите иодное число данного образца миндального масла. Ответ: 95.
Навеску порошка растёртых таблеток аскорбиновой кислоты (М = 176,13 г/моль) массой 0,3990 г растворили в 10 мл воды. К раствору прибавили 0,5 мл 1% раствора KI, 2 мл раствора крахмала, 1 мл 2% раствора HCl. Для титрования полученного раствора было израсходовано 11,20 мл 0,1000 М 1/6KIO3. Рассчитайте среднюю массу аскорбиновой кислоты в 1 таблетке. Масса 20 таблеток равна 4,040 г. Ответ: 4,99310-2 г.
Какой объём 0,1008 М Na2S2O3 потребуется для взаимодействия с иодом, полученным в результате реакции 25,00 мл раствора монохлорида иода (М = 162,36 г/моль), имеющего титр 8,10210-3 г/мл, с избытком иодида калия?
Навеску образца персикового масла массой 0,1128 г растворили в 3 мл диэтилового эфира. К раствору прибавили 20,00 мл раствора монохлорида иода. Полученную смесь взбалтывали в течение 1 часа, а затем добавили к ней 10 мл 10% раствора KI и 50 мл воды. Для титрования выделившегося иода потребовалось 12,3 мл 0,09875 М Na2S2O3. Определите иодное число данного образца персикового масла, если в контрольном опыте для титрования было израсходовано 21,3 мл такого же раствора тиосульфата натрия.
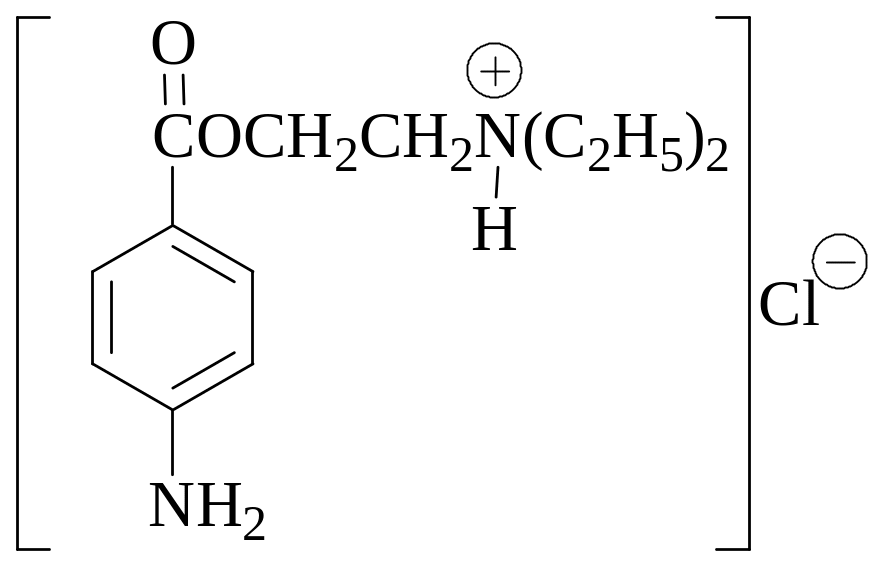
Навеску образца новокаина (М = 272,78 г/моль) массой 0,0791 г растворили в горячей воде. К полученному раствору прибавили 20 мл 0,1036 М 1/2ICl и после взбалтывания в течение 30 минут 10 мл 10% раствора KI. Выделившийся иод оттитровали 0,09321 М Na2S2O3. Рассчитайте массовую долю новокаина в анализируемом образце, если для титрования было израсходовано 10,60 мл раствора тиосульфата натрия.Навеску образца стрептоцида (М = 172,21 г/моль) массой 0,5000 г растворили в 5 мл 2 М HCl. Раствор разбавили водой до 100,0 мл. К 5,00 мл полученного раствора добавили 50 мл горячей воды, 20,00 мл 0,1080 М 1/2 ICl. После перемешивания полученной смеси в течение 30 минут и охлаждения до комнатной температуры к ней добавили 10 мл 10% раствора KI. Для титрования выделившегося иода потребовалось 15,75 мл 0,1039 М Na2S2O3. Определите массовую долю стрептоцида в анализируемом образце.
Для титрования аскорбиновой кислоты, содержащейся в пробе инъекционного раствора объёмом 5,00 мл, потребовалось 28,20 мл раствора иодата калия, для приготовления 100,0 мл которого была использована навеска KIO3 массой 0,3567 г. Рассчитайте массу аскорбиновой кислоты, содержащейся в 1 мл анализируемого раствора.
Пробу объёмом 20,00 мл раствора, содержащего гидразин, количественно разбавили водой до 100,0 мл. Для титрования 10,00 мл полученного раствора в сильнокислой среде (HCl) потребовалось 21,50 мл 0,02000 М KIO3. Рассчитайте массовую концентрацию (г/л) гидразина в анализируемом растворе.
Для титрования порошка, полученного из 10 таблеток антигипертензивного лекарственного вещества гидралазина гидрохлорида (апрессина), в молекуле которого присутствует гидразидная группа, было израсходовано в сильнокислой среде (HCl) 10,20 мл 0,05000 М KIO3. Рассчитайте массу апрессина, содержащегося в 1 таблетке. Апрессин и иодат калия реагируют в молярном соотношении 1:1. Молярная масса апрессина равна 196,6 г/моль.
К 10,00 мл раствора нитрита натрия прибавили 25,00 мл 0,02000 М KMnO4 и 10 мл 20% раствора серной кислоты. Через 10 минут к полученному раствору добавили 0,5 г KI и оттитровали выделившийся иод. Для титрования иода потребовалось 6,50 мл 0,05000 М Na2S2O3. Рассчитайте молярную концентрацию NaNO2 в стандартизируемом растворе.
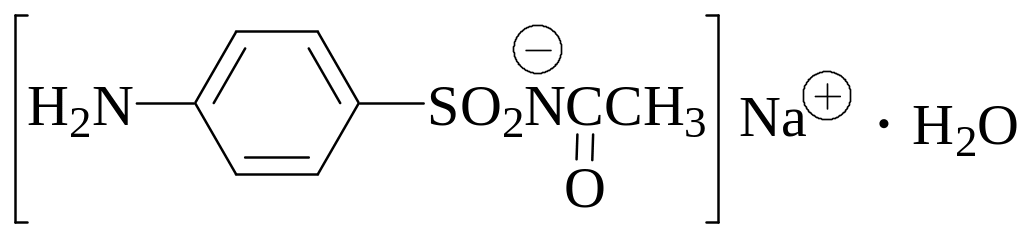
Навеску массой 0,9955 г образца мази, содержащей сульфацил-натрий (М = 254,24 г/моль) - лекарственное вещество из группы сульфаниламидов, растворили при нагревании в растворе HCl. Для титрования полученного раствора потребовалось 11,60 мл раствора нитрита натрия, имеющего титр по сульфаниловой кислоте 1,75010-2 г/мл. Рассчитайте массовую долю сульфацила-натрия в анализируемой мази.Натрия парааминосалицилат (дигидрат, М = 211,2 г/моль) используется для лечения туберкулёза. Навеску массой 0,4042 г порошка растёртых таблеток, содержащих данное лекарственное вещество, растворили в 60 мл смеси воды и хлороводородной кислоты. К полученному раствору добавили 1 г бромида калия и оттитровали 0,1000 М NaNO2 в присутствии индикатора тропеолина 00. Для титрования было израсходовано 11,45 мл титранта. Рассчитайте массу натрия парааминосалицилата в 1 таблетке, если известно, что масса 20 таблеток была равна 17,100 г.
ПРИГОТОВЛЕНИЕ И СТАНДАРТИЗАЦИЯ РАСТВОРА НИТРИТА НАТРИЯ. НИТРИТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ СТРЕПТОЦИДА
