
- •Занятие 13
- •Цель занятия
- •3. Гидроксид алюминия является лёгким аморфным осадком. Его оптимальная масса, как осаждаемой формы, при гравиметрическом определении составляет примерно:
- •4. При проведении гравиметрических определений методом осаждения навеску исходного вещества растворяют в воде (или другом растворителе) в таком соотношении, чтобы получился примерно:
- •5. Что из перечисленного неверно?
- •Предварительные расчёты
- •Занятие 14
- •Цель занятия
- •Результаты, полученные студентами первой группы
- •Занятие 15
- •Занятие 16
- •Цель занятия
- •2. Обратное титрование применяют, если:
- •3. В процессе косвенного титрования:
- •4. Согласно методике анализа Вам необходимо добавить к анализируемому раствору 10,00 мл стандартного раствора титранта. Какой мерной посудой Вы воспользуетесь?
- •5. Что из перечисленного неверно?
- •1. Проверка вместимости мерной колбы
- •2. Проверка вместимости пипетки
- •3. Проверка вместимости бюретки
- •Проверка вместимости бюретки
- •4. Определение объёма капли
- •Занятие 17
- •Цель занятия
- •9. Какие из перечисленных ниже индикаторов в водном растворе, имеющем рН 2, будут окрашены в красный цвет?
- •10. К 10 мл 0,1 м раствора вещества 0,1 моль/л добавляют 1 каплю 1% этанольного раствора фенолфталеина. В растворах каких веществ при этом произойдёт появление окраски?
- •1. Приготовление и стандартизация 0,1 м hCl
- •2. Приготовление и стандартизация 0,1 м koh
- •Занятие 18
- •Цель занятия
- •10. Что из перечисленного ниже неверно?
- •Цель занятия
- •Цель занятия
- •Занятие 21
- •Цель занятия
- •1. Приготовление и стандартизация 0,05 м эдта
- •2. Комплексонометрическое определение сульфата цинка
- •3. Комплексонометрическое определение хлорида кальция
- •Занятие 22
- •Цель занятия
- •1. Что из перечисленного верно?
- •1. Стандартизация 0,1м AgNo3
- •2. Аргентометрическое определение ki
- •Занятие 23
- •Цель занятия
- •3. Какая из перечисленных ниже формул принадлежит n-фенилантраниловой кислоте?
- •5. Редуктор Джонса:
- •10. Реактив к.Фишера представляет собой смесь:
- •1. Стандартизация раствора тиосульфата натрия
- •2. Иодометрическое определение пероксида водорода
- •Цель занятия
- •1. Какие из веществ, формулы которых приведены ниже, могут быть определены методом нитритометрического титрования на основе реакции диазотирования?
- •2. Что из перечисленного ниже верно?
- •1. Приготовление и стандартизация 0,1 м NaNo2
- •2. Нитритометрическое определение стрептоцида
- •Занятие 25
- •Цель занятия
- •1. Стандартизация 0,05 м 1/5kMnO4
- •2. Перманганатометрическое определение пероксида водорода
- •Занятие 26
- •Цель занятия
1. Стандартизация 0,1м AgNo3
Стандартизацию раствора AgNO3 проводят по следующей методике. Точную навеску NaCl массой около 0,6 г растворяют в воде в мерной колбе вместимостью 100,0 мл и доводят водой до метки. В три колбы для титрования вносят по 10,00 мл приготовленного раствора, прибавляют 2 мл 5% раствора K2CrO4 и титруют раствором AgNO3 до появления красноватого осадка.
Расчёт молярной концентрации AgNO3 в стандартизируемом растворе проводят по формуле
![]()
где М(NaCl) = 58,44 г/моль, Vк = 100,0 мл, Vп = 10,00 мл
2. Аргентометрическое определение ki
Определение KI проводят по следующей методике. Точную навеску KI массой около 0,15 г растворяют в 10 мл воды, прибавляют 1 мл раствора CH3COOH (~30%), 3 капли 0,1% раствора эозината натрия и титруют раствором AgNO3 до перехода окраски осадка из желтой в розовую.
Массовую долю KI в образце рассчитывают по формуле
![]()
где M(KI) = 166,01 г/моль
либо по аналогичной формуле с использованием титра соответствия.
Занятие 23
Цель занятия
Знать:
общую характеристику и классификацию методов окислительно-восстановительного титрования, требования к используемым реакциям;
алгоритм построения простейшей кривой окислительно-восстановительного титрования;
способы обнаружения конечной точки титрования в методах окислительно-восстановительного титрования, общую характеристику и принцип действия окислительно-восстановительных индикаторов;
общую характеристику, титранты и стандартные вещества, условия выполнения и практическое применение иодометрического титрования.
Уметь:
проводить стандартизацию раствора тиосульфата натрия;
выполнять иодометрическое определение пероксида водорода.
Общая характеристика и классификация методов окислительно-восстановительного титрования. Требования к используемым реакциям.
Типичная кривая окислительно-восстановительного титрования. Факторы, влияющие на величину скачка титрования.
Способы обнаружения конечной точки титрования при окислительно-восстановительном титровании.
Окислительно-восстановительные индикаторы. Принцип действия. Основные представители. Интервал перехода окраски. Понятие об индикаторных погрешностях.
Иодометрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение. Определение воды методом Карла Фишера.

Представьте себе, что при титровании протекает реакция: Ox1 + Red2 Red1 + Ox2, в которой одна частица восстановителя (Red2) отдаёт одной частице окислителя (Ox1) один электрон. При каком значении Kравн и E0 данную реакцию можно считать количественной (степень превращения реагирующих веществ в продукты реакции > 99,9%)?
Почему кривые титрования в окислительно-восстановительном титровании (в отличие от других видов титрования - кислотно-основного, комплексометрического, осадительного) начинают строить не с того момента, когда f = 0. От чего зависит, главным образом, величина скачка титрования в окислительно-восстановительном титровании. В каких случаях ход кривой окислительно-восстановительного титрования зависит и в каких не зависит от разбавления?
Исходя из каких критериев производят выбор окислительно-восстановительного индикатора для обнаружения конечной точки окислительно-восстановительного титрования. Чем вызвано появление систематической индикаторной погрешности? Рассчитайте величину такой погрешности при титровании FeSO4 раствором Сe(SO4)2 в 1 М H2SO4 (
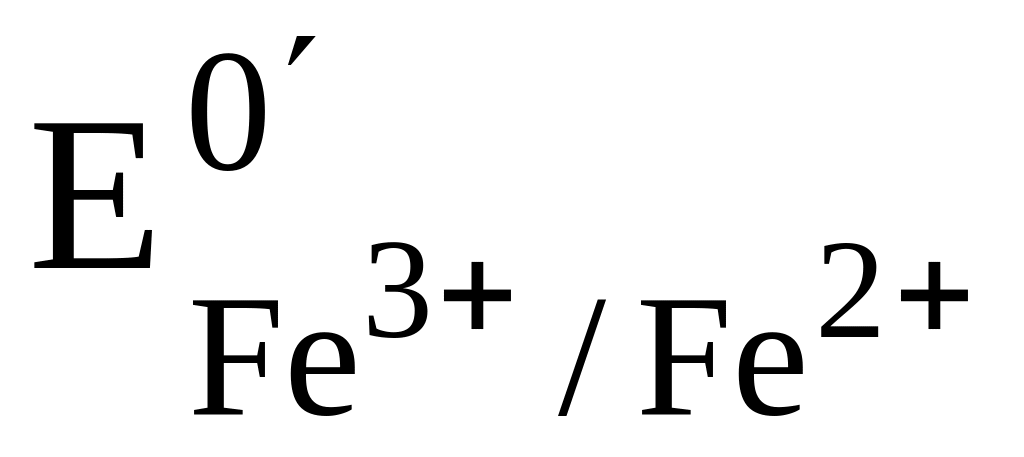 =+0,68В,
=+0,68В,
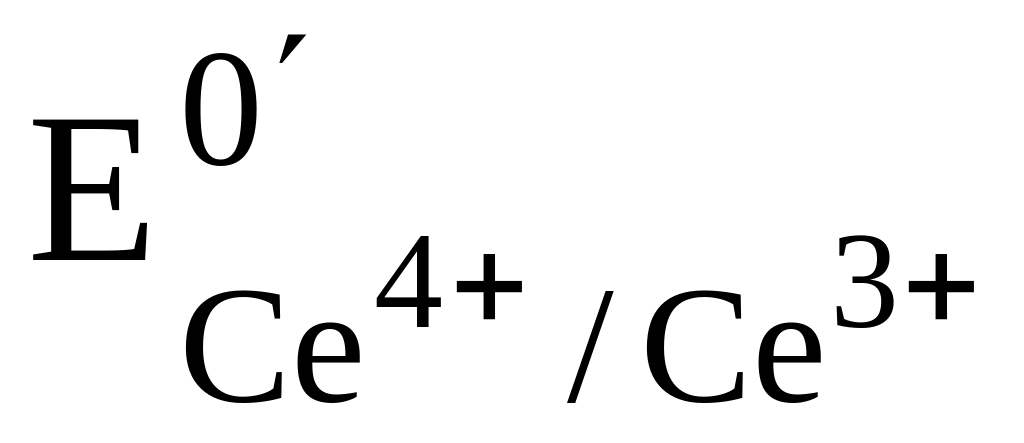 =+1,44В),
если в качестве индикатора использован
нитроферроин.
=+1,44В),
если в качестве индикатора использован
нитроферроин.
Приведите примеры одноцветных и двухцветных окислительно-восстановительных индикаторов. Почему у 2,6-дихлорфенолиндофенола величина электродного потенциала сильно зависит от рН (+0,668 В при рН 0 и +0,217 В при рН 7), в то время как у ферроина практически не зависит?
Кристаллический иод плохо растворим в воде (концентрация I2 в насыщенном водном растворе составляет 1,3310-3 моль/л). В водном растворе KI растворимость иода значительно увеличивается вследствие протекания реакции:
I2(водн) + I- I3-
Рассчитайте равновесную концентрацию I2(водн) в растворе при равновесной концентрации I- 0,2 моль/л и равновесной концентрации I3- 0,05 моль/л, если константа равновесия данной реакции равна 7102. Объясните, почему стандартные растворы иода (трииодида) следует хранить в сосудах с притёртой пробкой, на холоду, в защищённом от света месте. Как влияет рН, наличие растворённого кислорода и ионов тяжёлых металлов на качество таких стандартных растворов?
Иодометрическое определение многих органических соединений проводят в щелочной среде. При этом к определяемому веществу добавляют взятое в заведомом избытке точное количество стандартного раствора иода. Через некоторое время, необходимое для протекания реакции определяемого вещества с иодом, к раствору добавляют серную кислоту и титруют избыток иода стандартным раствором тиосульфата натрия. Объясните, почему титрование иода тиосульфатом натрия нельзя было проводить в щелочной среде. Какую среду (сильнокислую, слабокислую) должен иметь раствор после добавления серной кислоты?
Почему при добавлении крахмала (амилозы) к раствору иода появляется синее окрашивание? Какие ещё вещества могут взаимодействовать с иодом аналогичным образом? Какие факторы влияют на чувствительность реакции иода с крахмалом?
Предложите возможный алгоритм количественного анализа водного раствора, содержащего ацетон и уксусную кислоту. В Вашем распоряжении имеется любая мерная посуда и следующие реактивы: 0,0500 M I2, 0,1000 М Na2S2O3, 0,1000 M NaOH, 1 М NaOH, 1 M 1/2H2SO4, растворы метилового оранжевого, фенолфталеина и крахмала.
Что такое «активный хлор»? Приведите примеры лекарственных веществ, стандартизируемых по активному хлору. Как определяют содержание активного хлора в веществе? Может ли массовая доля активного хлора в веществе быть больше 100%?
Объясните принцип определения воды методом Карла Фишера. Какую роль играют метанол и пиридин? Как обнаруживают конечную точку титрования реактивом Карла Фишера?
1. При каком значении степени оттитрованности FeSO4 раствором KMnO4 величина электродного потенциала будет равна стандартному потенциалу пары Fe3+/Fe2+?
1) 0,250; 2) 0,500; 3) 0,750;
4) 1,000; 5) 1,500.
2. Для каких из перечисленных ниже реакций точка эквивалентности не будет находиться в середине скачка титрования (во всех случаях рН = 1)?
Fe2+ + Ce4+ Fe3+ + Ce3+
5Fe2+ + MnO4- + 8H+ 5Fe3+ + Mn2+ + 4H2O
6Fe2+ + Cr2O72- + 14H+ 6Fe3+ + 2Cr3+ + 7H2O
Fe3+ + Ti3+ + H2O Fe2+ + TiO2+ + 2H+
Fe3+ + Cr2+ Fe2+ + Cr3+
