
- •Занятие 13
- •Цель занятия
- •3. Гидроксид алюминия является лёгким аморфным осадком. Его оптимальная масса, как осаждаемой формы, при гравиметрическом определении составляет примерно:
- •4. При проведении гравиметрических определений методом осаждения навеску исходного вещества растворяют в воде (или другом растворителе) в таком соотношении, чтобы получился примерно:
- •5. Что из перечисленного неверно?
- •Предварительные расчёты
- •Занятие 14
- •Цель занятия
- •Результаты, полученные студентами первой группы
- •Занятие 15
- •Занятие 16
- •Цель занятия
- •2. Обратное титрование применяют, если:
- •3. В процессе косвенного титрования:
- •4. Согласно методике анализа Вам необходимо добавить к анализируемому раствору 10,00 мл стандартного раствора титранта. Какой мерной посудой Вы воспользуетесь?
- •5. Что из перечисленного неверно?
- •1. Проверка вместимости мерной колбы
- •2. Проверка вместимости пипетки
- •3. Проверка вместимости бюретки
- •Проверка вместимости бюретки
- •4. Определение объёма капли
- •Занятие 17
- •Цель занятия
- •9. Какие из перечисленных ниже индикаторов в водном растворе, имеющем рН 2, будут окрашены в красный цвет?
- •10. К 10 мл 0,1 м раствора вещества 0,1 моль/л добавляют 1 каплю 1% этанольного раствора фенолфталеина. В растворах каких веществ при этом произойдёт появление окраски?
- •1. Приготовление и стандартизация 0,1 м hCl
- •2. Приготовление и стандартизация 0,1 м koh
- •Занятие 18
- •Цель занятия
- •10. Что из перечисленного ниже неверно?
- •Цель занятия
- •Цель занятия
- •Занятие 21
- •Цель занятия
- •1. Приготовление и стандартизация 0,05 м эдта
- •2. Комплексонометрическое определение сульфата цинка
- •3. Комплексонометрическое определение хлорида кальция
- •Занятие 22
- •Цель занятия
- •1. Что из перечисленного верно?
- •1. Стандартизация 0,1м AgNo3
- •2. Аргентометрическое определение ki
- •Занятие 23
- •Цель занятия
- •3. Какая из перечисленных ниже формул принадлежит n-фенилантраниловой кислоте?
- •5. Редуктор Джонса:
- •10. Реактив к.Фишера представляет собой смесь:
- •1. Стандартизация раствора тиосульфата натрия
- •2. Иодометрическое определение пероксида водорода
- •Цель занятия
- •1. Какие из веществ, формулы которых приведены ниже, могут быть определены методом нитритометрического титрования на основе реакции диазотирования?
- •2. Что из перечисленного ниже верно?
- •1. Приготовление и стандартизация 0,1 м NaNo2
- •2. Нитритометрическое определение стрептоцида
- •Занятие 25
- •Цель занятия
- •1. Стандартизация 0,05 м 1/5kMnO4
- •2. Перманганатометрическое определение пероксида водорода
- •Занятие 26
- •Цель занятия
3. Какая из перечисленных ниже формул принадлежит n-фенилантраниловой кислоте?
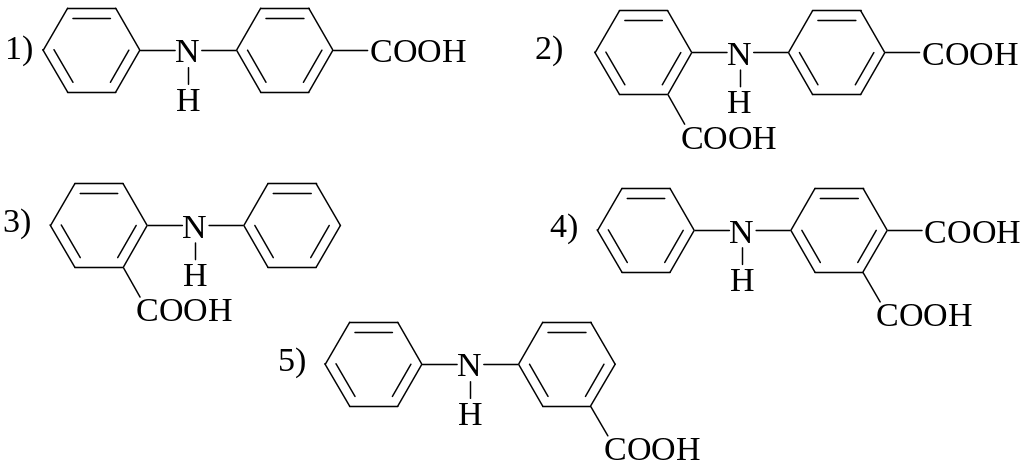
4. Какие из перечисленных окислительно-восстановительных индикаторов могут быть использованы для обнаружения конечной точки титрования раствора FeSO4 раствором Сe(SO4)2, протекающего в 1 М H2SO4, если в данных условиях =+0,68В, =+1,44В
1) нейтральный красный (E0 = +0,24В); 2) ферроин (E0 = +1,06В).
3) метиленовый синий (E0 = +0,36В);
4) 2,6-дихлорфенолиндофенол (E0 = +0,668В);
5) N-фенилантраниловая кислота (E0 = +1,00В);
5. Редуктор Джонса:
используется для окисления всех форм определяемого элемента до одной степени окисления;
используется для восстановления всех форм определяемого элемента до одной степени окисления;
используется для восстановления органических веществ с целью выделения неорганических;
представляет собой трубку, заполненную оксидом цинка (или высшим оксидом другого металла);
представляет собой трубку, заполненную амальгамированным цинком (или другим металлом).
6. Какие из перечисленных веществ можно количественно определить путём прямого титрования стандартным раствором трииодида
1) CuSO4; 2) Na2S2O3; 3) K2Cr2O7;
4) As2O3; 5) формальдегид
7. При иодометрическом определении каких веществ используется титрование заместителя?
1) CaOCl2; 2) аскорбиновая кислота; 3) CuSO4;
4) ацетон; 5) соли Sb(III)
8. При иодометрическом определении каких веществ крахмал необходимо добавлять незадолго до достижения конечной точки титрования?
1) формальдегид; 2) Na2S2O3; 3) NaClO;
4) глюкоза; 5) As2O3
9. Что из перечисленного ниже неверно?
появление окраски при взаимодействии крахмала с иодом обусловлено окислительно-восстановительной реакцией и является необратимым;
крахмал следует использовать как индикатор в иодометрии только при температуре близкой к комнатной;
растворы крахмала, используемые в качестве индикатора, должны быть свежеприготовленными;
в сильнокислой среде чувствительность реакции крахмала с иодом увеличивается;
раствор крахмала можно предохранить от микробного разрушения добавлением HgI2.
10. Реактив к.Фишера представляет собой смесь:
1) I2, пиридина, CH3OH и SO2; 2) KI, пиридина, CH3OH и SO2;
3) I2, H2O, CH3OH и SO2; 4) I2, пиридина, CH3OH и SO3;
5) KI, H2O, CH3OH и H2S.
Пробу, содержащую никотиновую кислоту (М = 123,11 г/моль), растворили в горячей воде. После охлаждения полученный раствор нейтрализовали по фенолфталеину раствором NaOH, добавили 20 мл 5% раствора CuSO4 и довели водой до 100,0 мл. Через 10 минут выпавший осадок отфильтровали, а к 50,00 мл полученного фильтрата добавили необходимое количество HCl, KI и через 10 минут оттитровали выделившийся иод 0,1000 М Na2S2O3. Рассчитайте массу никотиновой кислоты в пробе, если для титрования было израсходовано 19,00 мл раствора Na2S2O3, а в контрольном опыте – 32,50 мл этого же титранта.
В процессе данного титриметрического определения происходили следующие химические превращения. Вначале никотиновая кислота провзаимодействовала с NaOH с образованием растворимого в воде никотината натрия, затем был получен осадок никотината меди:
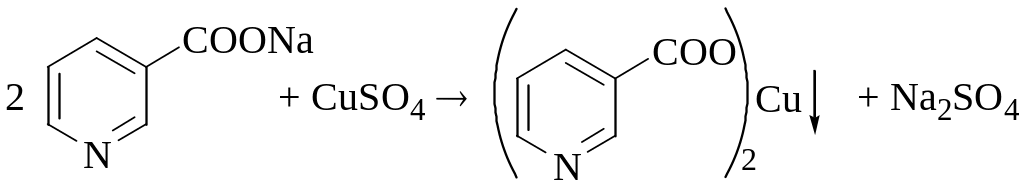
Полученный осадок был отфильтрован. Половину фильтрата подкислили с помощью HCl и добавили к нему избыток KI, при этом образовался осадок CuI и выделился I2.
2Cu2+ + 4I- 2CuI + I2
Выделившийся иод был оттитрован стандартным раствором Na2S2O3. Эквивалент Cu2+ в реакции с иодид-ионом равен формульной единице. С одним ионом Cu2+ взаимодействует 2 молекулы никотиновой кислоты, поэтому эквивалент последней в описанной методике равен двум формульным единицам
Концентрация CuSO4 в исходном растворе задана весьма приблизительно, но поскольку был проведён котрольный опыт, то для расчётов её величина и не требуется. Количество вещества Cu2+, провзаимодействовавшего с никотиновой кислотой, равно разности между количеством вещества Na2S2O3, использованным для титрования иода в контрольном опыте, и при анализе пробы. С учетом того, что для анализа, была взята половина фильтрата
![]() 0,6648 г
0,6648 г
Для титрования 25,00 мл 0,1010 М Na2S2O3 было израсходовано 24,40 мл раствора иода. Рассчитайте молярную концентрацию 1/2I2 в таком растворе и его титр по аскорбиновой кислоте (М = 176,13 г/моль). Ответ: 0,1035 моль/л, 9,11510-3 г/мл.
Навеску образца лекарственного вещества сурьмы натрия тартрата (C4H4NaO7Sb, M = 308,8 г/моль) массой 0,4890 г растворили в 50 мл воды. К полученному раствору добавили 5 г тартрата калия-натрия, 2 г тетрабората натрия и оттитровали его раствором иода. Рассчитайте массовую долю сурьмы натрия тартрата в анализируемом образце, если для титрования было израсходовано 31,50 мл 0,0500 М I2. Определение основано на окислении иодом Sb(III) до Sb(V). Ответ: 99,5%.
Навеску формалина (водного раствора формальдегида) массой 0,9900 г разбавили водой до 100,0 мл. К 5,00 мл полученного раствора прибавили 20,00 мл 0,1000 М 1/2I2, 10 мл 0,1 М NaOH и оставили на 10 минут в защищённом от света месте. Затем к раствору добавили 11 мл 0,1 М 1/2H2SO4. Для титрования выделившегося иода потребовалось 8,80 мл 0,1000 М Na2S2O3. Рассчитайте массовую долю формальдегида (М = 30,03 г/моль) в анализируемом растворе. Ответ: 34,0%.
Навеску образца хлорной извести массой 2,455 г растёрли с водой. Образовавшуюся однородную массу количественно перенесли в мерную колбу вместимостью 250,0 мл и довели водой до метки. К 25,00 мл полученного раствора прибавили 10 мл раствора KI (100 г/л), 10 мл 8,3%-ного раствора HCl и оттитровали выделившийся иод 0,1000 М Na2S2O3. Рассчитайте массовую долю активного хлора в исследуемом образце хлорной извести, если для титрования было израсходовано 22,90 мл раствора тиосульфата натрия. Ответ: 33,08%.
Определение воды в образце дигидрата цитрата натрия проводили методом Карла Фишера. Для титрования навески массой 0,3050 г потребовалось 8,30 мл реактива Карла Фишера, имеющего титр по воде 4,05010-3 г/мл. Какая масса воды содержится в 1 г анализируемого образца? Ответ: 0,1102 г.
Навеску дихромата калия массой 0,1525 г растворили в 50 мл воды. К полученному раствору добавили необходимые количества иодида калия и серной кислоты. Через 10 минут раствор разбавили водой. Для титрования выделившийся иода было израсходовано 30,50 мл раствора Na2S2O3. Рассчитайте молярную концентрацию тиосульфата натрия в стандартизируемом растворе и его титр по иоду.
Пробу объёмом 10,00 мл раствора, содержащего тиосульфат и гидрокарбонат натрия, разбавили свежепрокипячённой водой до 250,0 мл. Для титрования 25,00 мл полученного при этом раствора потребовалось 12,00 мл 0,1018 М 1/2I2. Рассчитайте массовую концентрацию (г/л) тиосульфата натрия в анализируемом растворе.
Пробу инъекционного раствора анальгина (М = 351,36 г/моль) объёмом 2,50 мл поместили в мерную колбу вместимостью 50,0 мл и довели 95%-ным этанолом до метки. К 5,00 мл полученного раствора добавили необходимое количество хлороводородной кислоты и провели титрование его 0,1000 М 1/2I2. Рассчитайте концентрацию анальгина в анализируемом растворе (г/мл), если для титрования было использовано 7,05 мл титранта.
Кофеин при взаимодействии с I2 (вещества вступают в реакцию в молярном соотношении 1:2) образует осадок перииодида кофеина. Методика иодометрического определения данного алкалоида основана на осаждении его в виде перииодида при добавлении взятого в заведомом избытке точного количества иода, удалении образовавшегося осадка (который также может взаимодействовать с тиосульфатом натрия), и титровании непрореагировавшего иода стандартным раствором Na2S2O3. К 4,00 мл инъекционного раствора, содержащего кофеин-бензоат натрия, добавили 30 мл воды. К полученному раствору прибавили необходимое количество H2SO4, 50,0 мл стандартного раствора иода и воду до 100,0 мл. Через 15 минут выпавший осадок отфильтровали. Для титрования 50,0 мл фильтрата потребовалось 9,90 мл 0,1050 М Na2S2O3, а в контрольном опыте - 19,70 мл. Рассчитайте массу кофеина, находящегося в 1 мл анализируемого раствора. Молярная масса кофеина равна 194,19 г/моль.
Навеску массой 0,1150 г образца лекарственного средства, содержащего глюкозу (М = 180,16 г/моль), растворили в воде. К полученному раствору прибавили 25,00 мл 0,1005 М 1/2I2 и 10 мл раствора Na2CO3. Через 10 минут к раствору добавили необходимое количество серной кислоты. Для титрования иода, не вступившего в реакцию с глюкозой, потребовалось 14,50 мл 0,0985 М Na2S2O3. Рассчитайте массовую долю глюкозы в анализируемом образце.
Навеску образца аминокислоты метионина (М = 149,21 г/моль) массой 0,2100 г растворили в 100 мл воды. К раствору прибавили 5 г K2HPO4, 2 г K3PO4, 2 г KI и 50,0 мл 0,1 М 1/2I2. Затем колбу закрыли и оставили на 30 минут, после чего избыток иода оттитровали 0,1000 М Na2S2O3. Рассчитайте массовую долю метионина в анализируемом образце, если для титрования было израсходовано 21,50 мл титранта (в контрольном опыте - 49,60 мл). Метионин взаимодействует с I2 в молярном отношении 1:1.
Иодометрическое определение HgCl2 (М = 271,50 г/моль) включает в себя реакцию данного вещества с KI с образованием K2[HgI4], восстановление образовавшегося комплексного соединения формальдегидом в щелочной среде до металлической ртути и окисление последней в кислой среде иодом (в присутствии KI) до K2[HgI4]. Навеску массой 0,2100 г образца сулемы растворили в воде. К полученному раствору прибавили необходимые количества иодида калия, хлорида кальция, формальдегида и гидроксида натрия. После встряхивания в течение 2-х минут к смеси добавили уксусную кислоту и 25,0 мл 0,1000 М 1/2I2. После растворения осадка металлической ртути к раствору добавили 10 мл раствора HCl и оттитровали присутствующий иод 0,1100 М Na2S2O3. Рассчитайте массовую долю HgCl2 в анализируемом образце, если для титрования было израсходовано 8,70 мл стандартного раствора тиосульфата натрия.
Навеску образца пентагидрата сульфата меди (М = 249,68 г моль) массой 0,5300 г растворили в 25 мл воды. К полученному раствору прибавили необходимые количества серной кислоты и иодида калия. Для титрования выделившегося иода потребовалось 21,00 мл 0,1000 М Na2S2O3. Определите массовую долю CuSO45H2O в анализируемом образце.
Навеску образца хромового ангидрида массой 2,455 г растворили в воде, получив 500,0 мл раствора. К 25,00 мл полученного раствора прибавили 100 мл воды, 5 мл 8,3%-ного раствора HCl и 3 г KI. Через 10 минут выделившийся иод оттитровали раствором Na2S2O3. Рассчитайте массовую долю триоксида хрома в анализируемом образце, если для титрования потребовалось 36,10 мл раствора Na2S2O3, имеющего титр по иоду 1,25010-2 г/мл.
К навеске массой 0,9985 г образца растёртых таблеток пантоцида прибавили 40 мл воды и 5 мл раствора NaOH (100 г/л). Через некоторое время к полученному раствору добавили 10 мл раствора KI (100 г/л) и 10 мл 16%-ного раствора H2SO4. Для титрования выделившегося иода потребовалось 7,10 мл 0,1000 М Na2S2O3. Рассчитайте массу активного хлора, содержащегося в 1 таблетке, если средняя масса одной таблетки равна 0,1200 г.
СТАНДАРТИЗАЦИЯ РАСТВОРА ТИОСУЛЬФАТА НАТРИЯ. ИОДОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПЕРОКСИДА ВОДОРОДА.
