
- •Міністерство освіти і науки, молоді та спорту україни
- •Методичні вказівки.
- •Основні закони хімії.
- •Запитання до семінару
- •Методичні вказівки.
- •Квантові числа. Стан електрона в атомі можна описати за допомогою чотирьох квантових чисел.
- •До середини хіх ст. Було відкрито 63 хімічні елементи, вивчено їхні властивості і сполуки. Робилось багато спроб систематизувати відомі елементи, побудувати їх класифікацію.
- •Спільну електрону пару, або ковалентний зв’язкок, часто позначають рискою, наприклад н – н.
- •Запитання до семінару
- •Методичні вказівки.
- •Іі слідство із закона Гесса. Тепловий ефект реакції дорівнює сумі теплот згорання вихідних речовин мінус сума теплот згорання продуктів реакції.
- •Запитання до семінару
- •Методичні вказівки.
- •Визначення ступеня окиснення елементу.
- •Найважливіші окисники та відновники.
- •Класифікація реакцій окиснення – відновлення.
- •Запитання до семінару
- •Методичні вказівки.
- •5. Окислювальні властивості.
- •3. Взаємодія з кислотами.
- •4. Взаємодія з солями.
- •6. Дисоціація кислот.
- •Запитання до семінару
- •Методичні вказівки.
- •Запитання до семінару
- •Методичні вказівки.
- •1. Взаємодія з неметалами.
- •2. Взаємодія з металами
- •Запитання до семінару
- •Методичні вказівки.
- •Твердість води.
- •Запитання до семінару
Основні закони хімії.
Закон збереження маси речовин.
Цей закон спочатку російський вчений М.В. Ломоносов сформулював у 1748 році теоретично, а потім у 1756 році експериментально. Однак відкриття цього закону довгий час залишалося невідомим. Тому він повторно був сформульований у 1789 році французьким хіміком Лавуазьє.
У наш час цей закон формулюють так: маса речовин, які вступають у хімічну реакцію, дорівнює масі речовин, які утворюються внаслідок реакції. Між масою речовини та її енергією існує взаємозв’язок, який виражають рівнянням Ейнштейна:
Е = m c2,
де Е – енергія;
m – маса;
c – швидкість світла у вакуумі, яка чисельно дорівнює 2,997925 108 м/с.
Закон сталості складу.
Цей закон сформулював у 1808 році французський учений Ж.Пруст. Якісний та кількісний склад сполуки, яка має молекулярну будову, не залежить від способу її одержання. Закон сталості складу не є загальним. Він справедливий лише для речовин, які мають молекулярну будову.
Закон кратних відношень.
Цей закон був відкритий у 1803 році Дальтоном, формулюють так: якщо два елементи утворюють між собою декілька хімічних сполук, то маси одного елемента, які припадають на певну масу іншого елемента, відносяться між собою як невеликі цілі числа. Він справедливий лише для молекулярних сполук.
Закон еквівалентів.
Еквівалентом елемента або простої чи складної речовини називають таку їх кількість, яка приєднує або заміщує у хімічних реакціях один моль атомів гідрогену, або взаємодіє з одним еквівалентом будь-якої речовини. Позначають еквівалент Е, одиниця виміру – моль.
Закон об’ємних відношень.
Цей закон був відкритий у 1805 – 1808 роках французським хіміком Гей-Люссаком для реакцій, які перебігають у газовій фазі. Закон формулюють так: при незмінному тиску та температурі об’єми реагуючих газів відносяться між собою та до об’ємів одеожаних газоподібних продуктів реакції як невеликі цілі числа.
Закон Авогадро та його наслідки.
Італійський вчений Амадео Авогадро передбачив, що молекули простих газоподібних речовин – двоатомні. Закон Авогадро формулюють так: у однакових об’ємах різних газів за однакових умов (температурі та тиску) міститься однакове число молекул.
Даний закон має два наслідки:
моль будь-якого газу при однакових умовах займає однаковий об’єм. Обчислюють молярний об’єм газу за формулою: Vm =
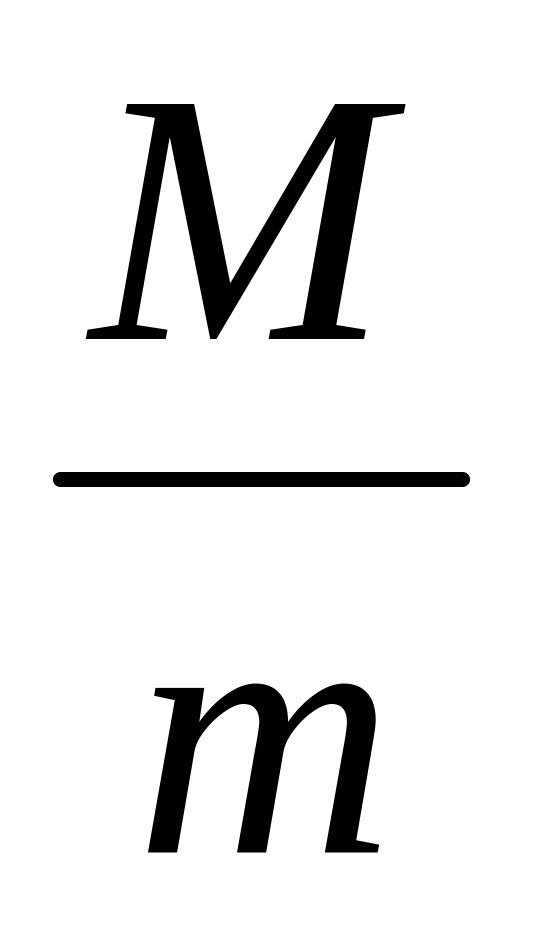 ,
,
де Vm - об’єм, який займає 1 моль газоподібної речовини за н.у.;
М – молярна маса цієї речовини;
m – маса 1 л газоподібної речовини за н.у..
відношення мас однакових об’ємів різних газів, які знаходяться в однакових умовах, називають густиною одного газу за іншим. Визначається за формулою: D =
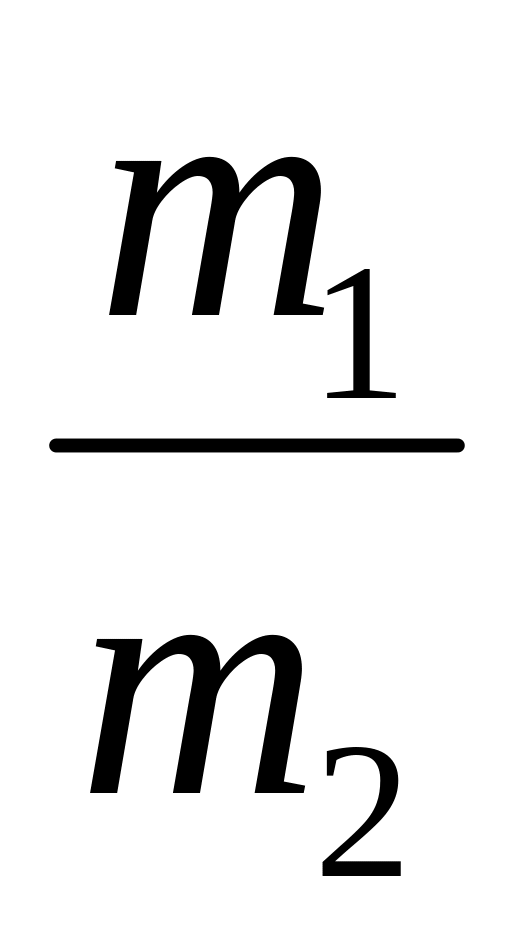
Хімічні реакції взаємодії кисню з речовинами називаються окисненням, а сполуки елементів з киснем – оксидами.
Фосфор, згораючи, окислюється й утворюється оксид фосфору P2O5. Вугілля, сірка, залізо, згораючи, окислюються й утворюють оксиди: вуглекислий газ СО2 – оксид вуглнцю, сірчистий газ SO2 – оксид сірки, залізну окалину Fe3O4 – оксид заліза.
Оксиди, що взаємодіють з кислотами з утворенням солі й води, називають основами.
Основні оксиди утворюють тільки метали. Наприклад: оксид магнію MgO, оксид кальцію CaO, оксид барію BaO.
Оксиди, які взаємодіють з основами з утворенням солі й води, називаються кислотами. Назвали їх так тому, що кожному кислотному оксидові відповідає кислота: CO2 – H2CO3, SO2 – H2SO3, SiO2 – H2SiO3, P2O5 – H3PO4.
Кислоти – це складні речовини, що складаються з атомів гідрогену та кислотного залишку. У природі є багато кислот: лимонна кислота в лимонах, яблучна кислота в яблуках, щавлева кислота у листках щавлю. Мурашки захищаються від ворогів, вибрискуючи їдкі крапельки мурашиної кислоти. (Вони містять також у бджолиній отруті та у волосках жалкої кропиви). Коли прокисає виноградний сік, утворюється всім відома оцтовакислота (“оцет”), а коли молоко – молочна кислота. Ця кислота утворюється також, коли квасять капусту, силосують корми для худоби.
Солі складаються із іона метала і кислотного залишку. Вони можуть бути отримані різними спосабами. Наприклад, при взаємодії кислот або кислотних оксидів з основами, або основним оксидом:
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
N2O5 + CaO = Ca(NO3)2
Продукти повного заміщення атомів водню в кислоті атомами метала називаються звичайними солями. Наприклад,CuSo4 – сірчанокисла мідь, FeSO4 – закисне сірчанокисле залізо.
Для багатоосновних кислот, крім звичайних, також існують і кислі солі (гідросолі). Кислі солі являються продуктом чосткового заміщення атомів водню кислоти на метал (NaHSO4, KH2PO4).
Основні солі (гідроксосолі) являються продуктом часткового заміщення гідроксильних груп в молекулах основ на кислотні остатки.Наприклад: AI(OH)2CI – хлорид дигідроксоалюмінія, AIOHCI2 – хлорид гідроскоалюмінія.
Середні солі – продукти повної нейтралізації кислоти основою. В них як катіони виступають катіони металів, групи атомів та комплексні катіони: КСІ, СаSO4, Zn(NO3)2, NH4NO3, Cu(NH3)4SO4.
Гідроксиди – це продукти взаємодії основних та кислотних оксидів з водою. Гідроксиди, залежно від хімічної природи елемента, можуть бути основними, кислотними та амфотерними.
Наприклад: NaOH – основний, АІ(ОН)3 – амфотерний, а гідроксиди силіцію, фосфору (V), сульфуру (VІ), та хлору (VІІ) – кислоти.
Основами називають електроліти, що дисоціюють у розчині з утворенням гідроксид-іонів ОН-. Кількість гідроксогруп у молекулі основи визначають їх кислотність. Наприклад, NaOH – однокислотна основа, Mg(ОН)2 – двокислотна основа, Cr(ОН)3 – трикислотна. По здатності розчинення у воді основи поділяються на розчинні, малорозчинні та нерозчинні. Розчинні у воді основи називають лугами. За силою (за ступенем дисоціації) основи поділяються на сильні NaOH; основи середньої сили Mg(ОН)2 та слабкі Ві(ОН)3. Більшість слабких основ малорозчинні у воді.
