
- •Глава 13
- •13.1.3. Нахождение в природе, изотопный состав
- •13.1.4. Краткие исторические сведения
- •13.2. Простые вещества
- •13.2.2. Металлический алюминий
- •13.2.3. Металлические галлий, индий и таллий
- •13.3. Сложные соединения элементов 13-й группы
- •13.3.1. Кислородные соединения
- •13.3.1.1. Борный ангидрид
- •13.3.1.2. Оксид алюминия (III)
- •13.3.1.3. Оксиды э2о3 элементов подгруппы галлия
- •13.3.1.4. Борные кислоты, бораты и эфиры
- •13.3.1.5. Гидроксид алюминия, алюминаты и соли алюминия (III)
- •13.3.1.6. Гидроксиды э(он)3 и соли элементов подгруппы галлия
- •13.3.1.7. Соединения элементов в низших степенях окисления
- •13.3.2. Галогениды
- •13.3.2.1. Галогениды бора
- •13.3.2.2. Галогениды алюминия
- •13.3.2.3. Тригалогениды элементов подгруппы галлия
- •13.3.2.2. Моногалогениды элементов подгруппы галлия
- •13.3.2.5. Дигалогениды элементов подгруппы галлия
- •13.3.3. Другие бинарные соединения
- •13.3.3.1. Водородные соединения
- •13.3.3.2. Азотные соединения
- •13.3.3.3. Бориды, карбиды, фосфиды
- •13.3.3.4. Халькогениды
- •13.4. Комплексные и металлоорганические соединения элементов 13-й группы
- •13.4.1. Комплексы бора
- •13.4.2. Комплексы алюминия и элементов подгруппы галлия
- •13.4.3. Металлоорганические соединения
- •13.5. Промышленное получение бора и металлических алюминия, галлия, индия, таллия
- •13.6. Биологическая роль элементов 13-й группы
13.3.2.2. Галогениды алюминия
В отличие от галогенидов бора, представляющих собой галогенангидриды и полностью гидролизующихся при контакте с водой, для алюминия (III) можно получить не только безводные, но и гидратированные галогениды. Гидраты АlХ3nН2О в разбавленных водных растворах сильно, но не полностью гидролизуются (см. разд. 13.3.1.5), создавая кислую среду [образуется гидроксокомплекс Al(OH)mX3 и mНХ]. Однако при концентрировании таких растворов происходит кристаллизация средних солей АlХ3nН2О, в которых координационную сферу иона Аl3+ (КЧ = 6) составляют главным образом молекулы воды, т.е. осуществляется связь Аl3+—ОН2. Поэтому свойства гидратов галогенидов алюминия были рассмотрены в разд. 13.3.1.5, а здесь рассмотрим безводные галогениды.
Свойства и строение безводных и гидратированных галогенидов АlIII сильно различаются. Например, АlСl3 в безводном состоянии больше похож на хлорангидрид, чем на соль. В отличие от гидрата АlСl36Н2О, кристаллический безводный хлорид алюминия имеет слоистую структуру с шестикоординированным атомом алюминия. При ТПЛ структура хлорида алюминия изменяется: образуется молекулярный димер Аl2Сl6 с КЧАl = 4, что приводит к резкому увеличению объема и понижению электропроводности раствора почти до нуля. Молекулы Аl2Сl6 имеют конфигурацию сдвоенных тетраэдров с общим ребром:
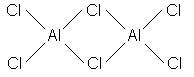
Атомы металла расположены в центре тетраэдров, а атомы галогена - в их вершинах. Четыре концевых атома галогена и два атома алюминия расположены в одной плоскости, при этом каждый атом АlШ имеет тетраэдрическое окружение. Димеры с ковалентными связями сохраняются в газовой фазе до ~2000С, выше - усиливается тенденция к перестройке его в треугольный АlСl3, изоструктурный ВХ3.
Как и в случае галогенидов бора, взаимодействие безводного АlСl3 с водой протекает бурно, сопровождаясь разогреванием и шипением. При этом образуется внутрисферный гидрат [Аl(ОН2)6]Сl3, в котором КЧАl = 6.
Сходны по строению безводные (и гидратированные) бромид и иодид АlШ, но безводные бромид и иодид имеют димерное строение в твердом, жидком и газообразном состоянии. Безводный фторид Аl кристаллизуется в структуре типа ReO3 (см. разд. 7.3.1.2 ), в которой искаженные октаэдры AlF6 соединены между собой. Поэтому трифторид алюминия тугоплавок и малорастворим.
Безводные тригалогениды алюминия нельзя получить обезвоживанием соответствующих гидратов, выделенных из водных растворов. Для синтеза безводных галогенидов АlХ3 используют прямой синтез (лабораторный метод) или взаимодействие различных кислородных соединений алюминия с галогенами. В промышленности для получения безводного АlСl3, широко используемого в качестве катализатора, а также в органическом и неорганическом синтезе, хлорируют при нагревании боксит или каолинит в присутствии углерода или СО:
Аl2О3 + 3Сl2 + 3СО 2АlСl3 + 3СО2.
Для алюминия (I) известны соединения АlХ со всеми галогенами, но они существуют лишь в газовой фазе в виде короткоживущих бинарных частиц. За неустойчивость моногалогенидов алюминия в конденсированной фазе ответственна реакция диспропорционирования на металл и более устойчивый тригалогенид:
3АlХ = 2Аl + АlХ3.
Обратная реакция при высокой температуре приводит к образованию газообразных АlХ.
Идентификация АlХ (как и Аl2О) осуществлена спектроскопически при высоких температурах, так как в обычных условиях соединения АlI неустойчивы.
