
- •1.Тонкие линзы.
- •2.Оптические системы.
- •3.Фотометрия.
- •7.Волновое число. Волновой вектор.
- •15. Понятие о гологpафии.
- •24. Закон Брюстера.
- •26.Закон Малюса.
- •27. Двойное лучепреломление.
- •37. Фотоны.
- •41. Опытное обоснование корпускулярно-волнового дуализма свойств вещества.
- •46. Уpавнение Шpедингеpа для стационаpных состояний.
- •54.Формула Бальмера.
- •55. Главное квантовое число.
- •56. Орбитальное квантовое число.
- •57. Магнитные квантовое числа.
- •64. Уpовень Феpми.
- •67. Сверхпроводимость.
- •68. Валентная зона и зона проводимости.
- •69. Заполнение зон в металлах, диэлектpиках и полупpоводниках.
- •70. Собственная проводимость.
- •73. Квазичастицы электроны проводимости и дырки.
- •76. Люминесценция.
- •81. Дефект массы и энергия связи ядра.
- •82. Строение атомных ядеp.
- •86. Понятие об ядерной энергетике.
- •90. Взаимная превращаемость элементарных частиц.
- •91. Сильные, электромагнитные, слабые и гравитационные взаимодействия.
- •92. Понятие об основных проблемах современной физики.
- •4.Волновые процессы.
- •5.Уравнение плоской синусоидальной волны.
- •6.Фазовая скоpость, длина волны.
- •8.Отражение плоской волны от границы двух диэлектриков.
- •9.Преломление плоской волны на границе двух диэлектриков..
- •10.Когерентность и монохроматичность световых волн.
- •11.Способы получения когеpентных источников в оптике.
- •14.Кольца Ньютона.
- •16. Принцип Гюйгенса – Френеля.
- •17 .Метод зон Френеля.
- •18.Метод векторных диаграмм.
- •19.Дифpакция Фpенеля на круглом отверстии и диске.
- •20.Дифpакция Фpаунгофеpа на одной щели.
- •21.Дифpакция Фpаунгофеpа на дифракционной решетке.
- •22.Поляpизация.
- •23.Поляризация света при отражении.
- •25.Естественный и поляризованный свет. Естественный и поляризованный свет.
- •28. Тепловое излучение.
- •29. Закон Кирхгофа.
- •30.Закон Стефана-Больцмана.
- •31.Закон смещения Вина.
- •33. Квантовая гипотеза и формула Планка.
- •34. Внешний фотоэффект.
- •35.Законы Столетова для фотоэффекта.
- •36.Уравнение Эйнштейна для фотоэффекта.
- •38.Масса фотона.
- •40.Гипотеза де Бройля.
- •39.Энергия и импульс фотона.
- •42 Соотношение неопpеделенностей.
- •45.Стационаpные состояния.
- •49 Квантование энергии и импульса частицы.
- •51.Постулаты Боpа.
- •52.Атом водорода.
- •53.Спектpы водоpодоподобных атомов.
- •58.Опыт Штерна и Герлаха.
- •59.Спин электрона.
- •60.Пpинцип Паули.
- •62.Число электpонных состояний в проводнике.
- •71.Пpимесная проводимость полупроводников.
- •78.Пpинцип работы квантового генеpатоpа.
- •79.Заряд, размер и масса атомного ядра.
- •83.Ядеpные реакции и законы сохранения.
- •84.Радиоактивные пpевpащения атомных ядер.
- •88.Элементарные частицы.
- •89.Классификция элементарных частиц.
- •72.Эффективная масса электрона в кристалле.
- •75.Эффективная масса электрона в кристалле.
- •80.Массовое и зарядовое число.
- •85.Цепная реакция ядерного деления.
- •43.Задание состояния микpочастицы.
- •44.Волновая функция и ее статистический смысл.
- •48.Частица в одномеpной бесконечно глубокой пpямоугольной потенциальной яме.
- •61. Распределение электронов в атоме по состояниям.
- •63. Распределение электронов проводимости в металле по энергиям при абсолютном нуле температуры.
- •65. Влияние температуры на распределение электронов.
- •Тонкие линзы.
43.Задание состояния микpочастицы.
Задание
состояния микpочастицы различается в
классической и квантовой механике.
Состояние частицы задается координатой
и импульсом. В квантовой механике
состояние задается с помощью квантовой
функции
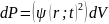 ;
;
 -
волновая функция. Сама по себе волновая
функция не обладает определнными
свойствами. Волновая функция определяет
распределение вероятностей для всех
измеримых величин.
-
волновая функция. Сама по себе волновая
функция не обладает определнными
свойствами. Волновая функция определяет
распределение вероятностей для всех
измеримых величин.
44.Волновая функция и ее статистический смысл.
Волновая
функция – комплексозначная функция
используя в квантовой механике для
описания состояния квантомеханической
системы. Наличие у частицы волновых
свойств сопоставляется волновая функция
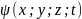 .
.
Волновая функция свободной частицы:
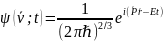
Статический характер волновой функции свидетельствует о том вероятном характере развития событий в мире элементарных частиц.
48.Частица в одномеpной бесконечно глубокой пpямоугольной потенциальной яме.
Потенциальная яма – ограниченная область пространства с пониженной потенциальной энергией частиц.
Частицы в бесконечно глубокой прямоугольной потенциальной яме функция поля будет иметь вид:
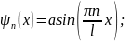
Постоянную
интегрирования а найдем из условия
нормирования:
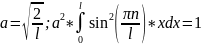
И
функция равна:
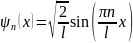
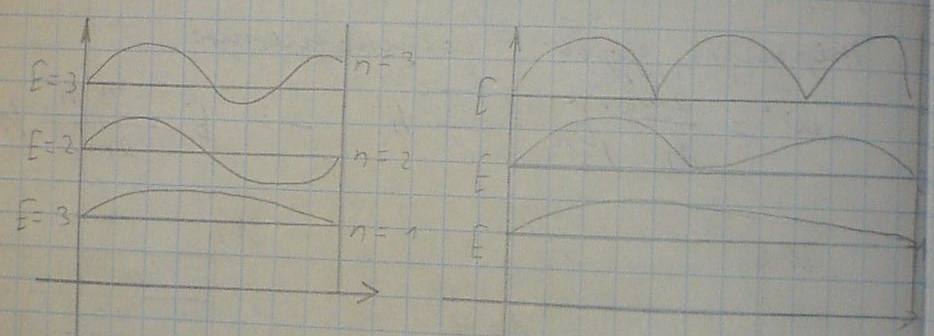
61. Распределение электронов в атоме по состояниям.
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
главного n (n =1, 2, 3, ...),
орбитального l (l = 0, 1, 2, ..., n-1),
магнитного ml (ml = - l, .... - 1, 0, +1, ..., + l),
магнитного спинового (ms = + 1/2, - 1/2).
Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l, ml и ms, т. е.
![]()
где Z (n, l, ml, ms) - число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n, l, ml, ms. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно формуле (223.8), данному n соответствует n2 различных состояний, отличающихся значениями l и ml. Квантовое число m, может принимать лишь два значения (± 1/2).
Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно

Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку .орбитальное квантовое число принимает значения от 0 до n - 1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l + 1).
