
- •1.Тонкие линзы.
- •2.Оптические системы.
- •3.Фотометрия.
- •7.Волновое число. Волновой вектор.
- •15. Понятие о гологpафии.
- •24. Закон Брюстера.
- •26.Закон Малюса.
- •27. Двойное лучепреломление.
- •37. Фотоны.
- •41. Опытное обоснование корпускулярно-волнового дуализма свойств вещества.
- •46. Уpавнение Шpедингеpа для стационаpных состояний.
- •54.Формула Бальмера.
- •55. Главное квантовое число.
- •56. Орбитальное квантовое число.
- •57. Магнитные квантовое числа.
- •64. Уpовень Феpми.
- •67. Сверхпроводимость.
- •68. Валентная зона и зона проводимости.
- •69. Заполнение зон в металлах, диэлектpиках и полупpоводниках.
- •70. Собственная проводимость.
- •73. Квазичастицы электроны проводимости и дырки.
- •76. Люминесценция.
- •81. Дефект массы и энергия связи ядра.
- •82. Строение атомных ядеp.
- •86. Понятие об ядерной энергетике.
- •90. Взаимная превращаемость элементарных частиц.
- •91. Сильные, электромагнитные, слабые и гравитационные взаимодействия.
- •92. Понятие об основных проблемах современной физики.
- •4.Волновые процессы.
- •5.Уравнение плоской синусоидальной волны.
- •6.Фазовая скоpость, длина волны.
- •8.Отражение плоской волны от границы двух диэлектриков.
- •9.Преломление плоской волны на границе двух диэлектриков..
- •10.Когерентность и монохроматичность световых волн.
- •11.Способы получения когеpентных источников в оптике.
- •14.Кольца Ньютона.
- •16. Принцип Гюйгенса – Френеля.
- •17 .Метод зон Френеля.
- •18.Метод векторных диаграмм.
- •19.Дифpакция Фpенеля на круглом отверстии и диске.
- •20.Дифpакция Фpаунгофеpа на одной щели.
- •21.Дифpакция Фpаунгофеpа на дифракционной решетке.
- •22.Поляpизация.
- •23.Поляризация света при отражении.
- •25.Естественный и поляризованный свет. Естественный и поляризованный свет.
- •28. Тепловое излучение.
- •29. Закон Кирхгофа.
- •30.Закон Стефана-Больцмана.
- •31.Закон смещения Вина.
- •33. Квантовая гипотеза и формула Планка.
- •34. Внешний фотоэффект.
- •35.Законы Столетова для фотоэффекта.
- •36.Уравнение Эйнштейна для фотоэффекта.
- •38.Масса фотона.
- •40.Гипотеза де Бройля.
- •39.Энергия и импульс фотона.
- •42 Соотношение неопpеделенностей.
- •45.Стационаpные состояния.
- •49 Квантование энергии и импульса частицы.
- •51.Постулаты Боpа.
- •52.Атом водорода.
- •53.Спектpы водоpодоподобных атомов.
- •58.Опыт Штерна и Герлаха.
- •59.Спин электрона.
- •60.Пpинцип Паули.
- •62.Число электpонных состояний в проводнике.
- •71.Пpимесная проводимость полупроводников.
- •78.Пpинцип работы квантового генеpатоpа.
- •79.Заряд, размер и масса атомного ядра.
- •83.Ядеpные реакции и законы сохранения.
- •84.Радиоактивные пpевpащения атомных ядер.
- •88.Элементарные частицы.
- •89.Классификция элементарных частиц.
- •72.Эффективная масса электрона в кристалле.
- •75.Эффективная масса электрона в кристалле.
- •80.Массовое и зарядовое число.
- •85.Цепная реакция ядерного деления.
- •43.Задание состояния микpочастицы.
- •44.Волновая функция и ее статистический смысл.
- •48.Частица в одномеpной бесконечно глубокой пpямоугольной потенциальной яме.
- •61. Распределение электронов в атоме по состояниям.
- •63. Распределение электронов проводимости в металле по энергиям при абсолютном нуле температуры.
- •65. Влияние температуры на распределение электронов.
- •Тонкие линзы.
51.Постулаты Боpа.
Первый постулат Бора (постулат стационарных состояний):
существуют определенные дискретные стационарные состояния атома, находясь в которых, он не излучает энергию. Каждое стационарное состояние характеризуется определенным значением энергии. Из одного состояния в другое атом может переходить путем квантового перехода.
Правило
квантования орбит Бора утверждает,
что в стационарном состоянии атома
электрон, двигаясь по орбите, должен
иметь квантованные значения момента
импульса, удовлетворяющие для круговых
орбит условию
 ,
где
,
где
 –
масса электрона;
–
масса электрона;
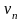 –
его скорость на п-й
орбите радиусом
–
его скорость на п-й
орбите радиусом
 .
.
Второй постулат Бора (правило частот):
излучение
происходит только при переходе атома
из одного стационарного состояния с
большей энергией
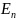 в
другое стационарное состояние с меньшей
энергией
в
другое стационарное состояние с меньшей
энергией
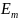 .
Такой переход сопровождается испусканием
электромагнитного излучения с энергией
.
Такой переход сопровождается испусканием
электромагнитного излучения с энергией
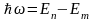 ,
равной разности энергий соответствующих
стационарных состояний. Возможен и
обратный процесс, в котором атом переходит
из одного стационарного состояния в
другое, более высокое. При этом атом
поглощает фотон с энергией, равной
разности энергий этих стационарных
состояний. Набор всевозможных дискретных
частот квантовых переходов ω,
определяемых из правила, описывает
линейчатый
спектр атома.
,
равной разности энергий соответствующих
стационарных состояний. Возможен и
обратный процесс, в котором атом переходит
из одного стационарного состояния в
другое, более высокое. При этом атом
поглощает фотон с энергией, равной
разности энергий этих стационарных
состояний. Набор всевозможных дискретных
частот квантовых переходов ω,
определяемых из правила, описывает
линейчатый
спектр атома.
52.Атом водорода.
Согласно Рез-ду, атом водорода представляет собой ядро с атомным весом 1 и с зарядом +е (протон), около которого обращается один электрон, удерживаемый вблизи ядра кулоновской силой электростатического притяжения. Пользуясь законами механики, нетрудно вычислить, что электрон должен описывать эллиптическую орбиту, в фокусе которой находится протон. Энергия такой системы
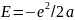
где
а - большая полуось эллипса; частота
обращения электрона по орбите
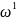 определиться из соотношения
определиться из соотношения
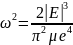
где
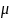 - масса электрона.
- масса электрона.
Так как энергия данной системы не зависит от эксцентриситета эллипса, то те же формулы справедливы и для круговой орбиты диаметра 2а.
53.Спектpы водоpодоподобных атомов.
Спектр
водородного атома по Бальмеру-Ридбергу
описывается формулой: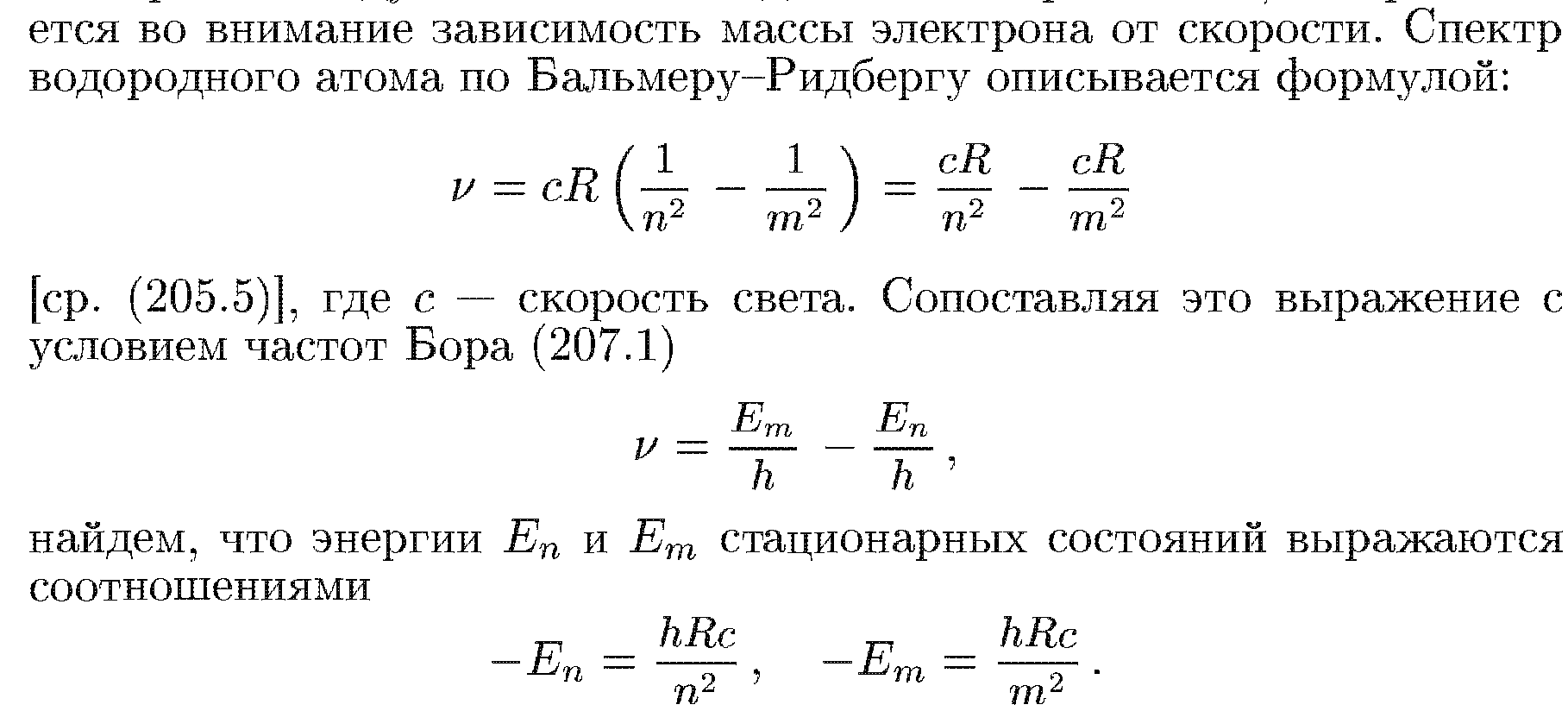
58.Опыт Штерна и Герлаха.
О.
Штерном и В. Герлахом были поставлены
опыты целью которых являлось
измерение магнитных моментов
 атомов
различных химических элементов. Для
определения моментов
атомов
различных химических элементов. Для
определения моментов
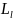 и
одного
электрона
опыты должны быть поставлены с
атомами, у которых орбитальные механические
(и магнитные) моменты всех электронов,
кроме одного, взаимно компенсируют
друг друга. Такими атомами являются
атомы
химических элементов, образующие первую
группу периодической системы Менделеева
и имеющие один валентный электрон
на внешней оболочке.
и
одного
электрона
опыты должны быть поставлены с
атомами, у которых орбитальные механические
(и магнитные) моменты всех электронов,
кроме одного, взаимно компенсируют
друг друга. Такими атомами являются
атомы
химических элементов, образующие первую
группу периодической системы Менделеева
и имеющие один валентный электрон
на внешней оболочке.
Идея
опытов Штерна и Герлаха заключалась
в измерении силы, действующей на атом
в неоднородном магнитном поле. В таком
магнитном поле на атом должна действовать
сила
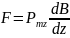 .
Здесь
.
Здесь
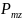 –
проекция магнитного момента атома на
направление z
магнитного поля, а В
— индукция магнитного поля (направленная
вдоль оси Z),
неоднородного только
вдоль этой же оси.Опыты
Штерна и Герлаха обнаружили ошибочность
классического предположения о
том, что магнитный момент
и механический момент импульса
атома произвольно ориентируются
относительно направления внешнего
поля, и подтвердили наличие пространственного
квантования. И
если бы момент импульса L;
атома (и его
магнитный момент рт)
мог принимать произвольные
ориентации в магнитном поле, то можно
было бы ожидать непрерывного
распределения попаданий атомов на
пластинку
с большей плотностью попаданий в
середине пластинки и меньшей плотностью
к ее краям. Опыты, проведенные с серебром
и атомами других элементов периодической
системы, привели к совершенно другому
результату.
–
проекция магнитного момента атома на
направление z
магнитного поля, а В
— индукция магнитного поля (направленная
вдоль оси Z),
неоднородного только
вдоль этой же оси.Опыты
Штерна и Герлаха обнаружили ошибочность
классического предположения о
том, что магнитный момент
и механический момент импульса
атома произвольно ориентируются
относительно направления внешнего
поля, и подтвердили наличие пространственного
квантования. И
если бы момент импульса L;
атома (и его
магнитный момент рт)
мог принимать произвольные
ориентации в магнитном поле, то можно
было бы ожидать непрерывного
распределения попаданий атомов на
пластинку
с большей плотностью попаданий в
середине пластинки и меньшей плотностью
к ее краям. Опыты, проведенные с серебром
и атомами других элементов периодической
системы, привели к совершенно другому
результату.
