
- •1)Основные понятия и законы химии
- •2) Количество вещества — величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
- •Химические свойства солей:
- •8) Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда).
- •9)Периодический закон д.И. Менделеева. Периодическая таблица (периоды и группы).
- •12) Термодинамические системы: открытые, закрытые, изолированные; гомогенные, гетерогенные. Параметры системы.
- •Термодинамические параметры:
- •13) Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
- •15) Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты.
- •Условия, влияющие на скорость химических реакций
- •19) Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •20) Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
Химические свойства солей:
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Основные способы получения солей:
1. Взаимодействие кислот с основаниями
NaOH + HCl = NaCl + H2O
2. Взаимодействие кислот с металлами, основными оксидами и солями
2HCl + Mg = MgCl2 + H2↑
3. Взаимодействие оснований с кислотными оксидами и солями.
Ca(OH)2 + CO2 = CaCO3↓ + H2O
4. Взаимодействие основных оксидов с кислотными оксидами.
Например:
MgO + CO2 = MgCO3
7) Квантово-механическая модель атома: уравнения де Бройля и Шредингера, принцип неопределенности Гейзенберга, атомная орбиталь, квантовые числа.
Согласно уравнению де Бройля (одному из основных уравнений квантовой механики)*,
лямбда=h/(mv), (1.6)
т. е. частице с массой т, движущейся со скоростью v, соответствует волна длиной лямбда; h — постоянная Планка.
В простейшем случае уравнение Шредингера может быть записано в виде
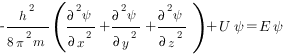
где h — постоянная Планка; m — масса частицы; U — потенциальная энергия; Е — полная энергия; х, у, z — координаты; Ψ — волновая функция.
Решая уравнение Шредингера, находят волновую функцию Ψ=f(x, y, z).
Cогласно принципу неопределенности Гейзенберга, невозможно определить траекторию движения электронов в атоме.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90%-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90%-ой плотности заряда электрона (как волны).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
Квантовое число |
Символ |
Описание |
Значения |
Главное |
n |
Энергетический уровень орбитали |
Положительные целые числа:1, 2, 3... |
Орбитальное |
l |
Форма орбитали |
Целые числа от 0 до n-1 |
Квантовое |
m |
Ориентация |
Целые числа от -l до +l |
Спиновое |
ms |
Спин электрона |
+½ и -½ |
