
- •1)Основные понятия и законы химии
- •2) Количество вещества — величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
- •Химические свойства солей:
- •8) Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда).
- •9)Периодический закон д.И. Менделеева. Периодическая таблица (периоды и группы).
- •12) Термодинамические системы: открытые, закрытые, изолированные; гомогенные, гетерогенные. Параметры системы.
- •Термодинамические параметры:
- •13) Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
- •15) Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты.
- •Условия, влияющие на скорость химических реакций
- •19) Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •20) Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
1)Основные понятия и законы химии
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений.
Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
2) Количество вещества — величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
Моля́рная ма́сса вещества — масса одного моля вещества.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
![]()
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
3) Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 . Они бывают солеобразующими и не образующие соли. При этом солеобразующие бывают 3-х типов: основными (от слова "основание"), кислотными и амфотерными.
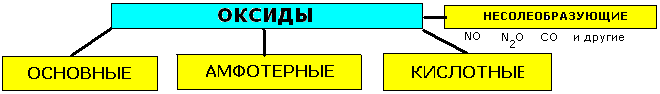 1.Основные-реагируют
с избытком кислоты с образованием соли
и воды.Основным оксидам соответствуют
основания.
1.Взаимодействие
с водой(оксиды щелочных и щелочноземельных
мет.)
CaO+H2O=Ca(OH)2
2.Все-с
кислотами
МgO+2HCl=MgCl2+H2O
3.С
кислотнями оксидами
CaO+CO2=CaCO3
4.С
амфотерными оксидами
Li2O+Al2O3=2LiAlO2
2.Амфотерные
(ZnO, Al2O3,Cr2O3,
MnO2
)
1.Взаимодействуют
как с кислотами, так и с
основаниями.
ZnO+2HCl=ZnCl2+H2O
ZnO+2NaOH+H2O=Na2[Zn(OH)4]
2.Реагируют
с основными и кислотными оксидами
ZnO+CaO=CaZnO2
ZnO+SiO2=ZnSiO3
1.Основные-реагируют
с избытком кислоты с образованием соли
и воды.Основным оксидам соответствуют
основания.
1.Взаимодействие
с водой(оксиды щелочных и щелочноземельных
мет.)
CaO+H2O=Ca(OH)2
2.Все-с
кислотами
МgO+2HCl=MgCl2+H2O
3.С
кислотнями оксидами
CaO+CO2=CaCO3
4.С
амфотерными оксидами
Li2O+Al2O3=2LiAlO2
2.Амфотерные
(ZnO, Al2O3,Cr2O3,
MnO2
)
1.Взаимодействуют
как с кислотами, так и с
основаниями.
ZnO+2HCl=ZnCl2+H2O
ZnO+2NaOH+H2O=Na2[Zn(OH)4]
2.Реагируют
с основными и кислотными оксидами
ZnO+CaO=CaZnO2
ZnO+SiO2=ZnSiO3
3.Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3
4) Основания-сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами -ОН.
Методы получения:
Взаимодействие металла с водой
|
|
|
Взаимодействие оксида с водой
|
|
|
Разложение соли водой (гидролиз)
|
|
|
Взаимодействие соли и щелочи
|
|
химические свойства:

5) Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.
Химические свойства кислот :
1.кислота + металл
(стоящий до водорода в ЭХР напряжений)
2HCl + Mg
![]() MgCl2
+ H2
MgCl2
+ H2![]() 2H+
+ 2Cl-
+Mg
Mg2+
+ 2Cl-
+ H2
2H+
+ Mg
Mg2+
+ H2
2H+
+ 2Cl-
+Mg
Mg2+
+ 2Cl-
+ H2
2H+
+ Mg
Mg2+
+ H2
2.кислота + основный оксид 2HCl + MgO MgCl2 + H2O 2H+ + 2Cl- +MgO Mg2+ + 2Cl-+ H2O 2H+ +MgO Mg2+ + H2O 3. кислота + основание HCl + NaOH NaCl + H2O H+ + Cl- + Na+ + OH- Na++ Cl- + H2O H+ +OH- H2O
4. кислота
+ соль
HCl +AgNO3
AgCl![]() + HNO3
H+
+ Cl-
+ Ag+
+ NO3-
AgCl
+ H+
+NO3-
Ag+
+ Cl-
AgCl
+ HNO3
H+
+ Cl-
+ Ag+
+ NO3-
AgCl
+ H+
+NO3-
Ag+
+ Cl-
AgCl
Получение кислот: - взаимодействие кислотных оксидов с водой: SO3 + H2O = H2SO4; CO2 + H2O = H2CO3; - взаимодействие с солями: NaCl + H2SO4(конц.) = HCl + Na2SO4 - взаимодействие неметаллов с водородом с последующим растворением их в воде: H2 + Cl2 = HCl - оксиление некоторых простых веществ: P + 5HNO3 +2H2O = 3H3PO4 + 5NO
6) Солями - сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков.

