
- •Билет №1
- •Билет №2
- •Физ свва
- •400 Кг/м³ (жидкий).
- •Билет №3
- •Билет №4
- •Билет№5
- •Основные промышленные группы 0%9f%d0%be%d0%bb%d0%b8%d0%bc%d0%b5%d1%80"полимеров, синтезируемых поликонденсацией
- •Билет №6
- •Билет №7
- •Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
- •Химические свойства
- •Химические свойства металлов
- •Билет №8
- •Физические свойства
- •Применение
Билет №1
1
Свойства простых тел... и соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
На основе периодического закона была составлена периодическая система элементов. В ней элементы со сходными свойствами оказались объединены в вертикальные столбцы — группы. В некоторых случаях при размещении элементов в Периодической системе приходилось нарушать последовательность возрастания атомных масс, чтобы соблюдалась периодичность повторения свойств. Например, пришлось "поменять местами" теллур и йод, а также аргон и калий.
Причина состоит в том, что Менделеев предложил периодической закон в то время, когда не было ничего известно о строении атома.
После того, как в XX веке была предложена планетарная модель атома, периодический закон формулируется следующим образом:
Свойства химических элементов и соединений находятся в периодической зависимости от зарядов атомных ядер.
Заряд ядра равен номеру элемента в периодической системе и числу электронов в электронной оболочке атома.
Эта формулировка объяснила "нарушения" Периодического закона.
В Периодической системе номер периода равен числу электронных уровней в атоме, номер группы для элементов главных подгрупп равен числу электронов на внешнем уровне.

Причиной периодического изменения свойств химических элементов является периодическое заполнение электронных оболочек. После заполнения очередной оболочки начинается новый период. Периодическое изменение элементов ярко видно на изменении состава и свойств и свойств оксидов.
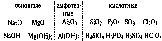
Научное значение периодического закона. Периодический закон позволил систематизировать свойства химических элементов и их соединений. При составлении периодической системы Менделеев предсказал существование многих еще не открытых элементов, оставив для них свободные ячейки, и предсказал многие свойства неоткрытых элементов, что облегчило их открытие.
2
Строение органических молекул
Органические молекулы в основном образованы 0%9A%D0%BE%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C"ковалентными неполярными связями C—C, или ковалентными полярными типа C—O, C—N, C—Hal. Согласно 0%9E%D0%BA%D1%82%D0%B5%D1%82%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D1%8F"октетной теории 0%9B%D1%8C%D1%8E%D0%B8%D1%81,_%D0%93%D0%B8%D0%BB%D0%B1%D0%B5%D1%80%D1%82_%D0%9D%D1%8C%D1%8E%D1%82%D0%BE%D0%BD"Льюиса и Косселя молекула является устойчивой, если внешние орбитали всех атомов полностью заполнены. Для таких элементов как 0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4"C, 0%90%D0%B7%D0%BE%D1%82"N, 0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"O, 0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D1%8B"Галогены необходимо 8 электронов, чтобы заполнить внешние0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%B0%D1%8F_%D0%BE%D1%80%D0%B1%D0%B8%D1%82%D0%B0%D0%BB%D1%8C&action=edit&redlink=1"валентныеHYPERLINK "http://ru.wikipedia.org/w/index.php?title=%D0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%B0%D1%8F_%D0%BE%D1%80%D0%B1%D0%B8%D1%82%D0%B0%D0%BB%D1%8C&action=edit&redlink=1" HYPERLINK "http://ru.wikipedia.org/w/index.php?title=%D0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%B0%D1%8F_%D0%BE%D1%80%D0%B1%D0%B8%D1%82%D0%B0%D0%BB%D1%8C&action=edit&redlink=1"орбитали, для 0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"водорода необходимо только 2 электрона. 0%9F%D0%BE%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D1%81%D1%82%D1%8C"Полярность объясняется смещением электронной плотности в сторону более 0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BE%D1%82%D1%80%D0%B8%D1%86%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D1%81%D1%82%D1%8C"электроотрицательного атома.
Классическая 0%A2%D0%B5%D0%BE%D1%80%D0%B8%D1%8F_%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D1%8B%D1%85_%D1%81%D0%B2%D1%8F%D0%B7%D0%B5%D0%B9"теория валентных связей не в состоянии объяснить все типы связей, существующие в органических соединениях, поэтому современная теория использует 0%A2%D0%B5%D0%BE%D1%80%D0%B8%D1%8F_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D1%85_%D0%BE%D1%80%D0%B1%D0%B8%D1%82%D0%B0%D0%BB%D0%B5%D0%B9"методы молекулярных HYPERLINK "http://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BE%D1%80%D0%B8%D1%8F_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D1%85_%D0%BE%D1%80%D0%B1%D0%B8%D1%82%D0%B0%D0%BB%D0%B5%D0%B9"орбиталей и квантовохимические методы.
Изомерия (от др.-греч. ἴσος — «равный», и μέρος — «доля, часть») — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические 0%A1%D0%BF%D0%B8%D1%80%D1%82%D1%8B"спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую «гомологическую разность». Чаще всего это метиленовые звенья: …—СН2—… Простейший пример гомологического ряда — низшие гомологи алканов (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.
3
Дисперсные системы, гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностъю раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме которой распределена дисперсная фаза (или несколько дисперсных фаз) в виде мелких кристаллов. твердых аморфных частиц, капель или пузырьков. Дисперсные системы могут иметь и более сложное строение, например, представлять собой двухфазное образование, каждая из фаз которого, будучи непрерывной, проникает в объем другой фазы. К таким системам относятся твердые тела. пронизанные разветвленной системой каналов-пор, заполненных газом илижидкостью. некоторые микрогетерогенные полимерные композиции и др. Нередки случаи, когда дисперсионная среда "вырождается" до тончайших слоев (пленок), разделяющих частицы дисперсной фазы.
1) Дисперсные системы различаются по степени измельчения вещества. Растворы хлорида натрия или этилового спирта в воде являются примерами истинных растворов. Они прозрачны, отдельных частиц в. них нельзя обнаружить даже с помощью микроскопа. Раствор белка в воде – коллоидный раствор. Коллоидные растворы прозрачны, но рассеивают свет – при пропускании света через прозрачный сосуд с раствором можно наблюдать светящийся конус. С помощью специального микроскопа в коллоидных растворах можно обнаружить отдельные частицы. Смесь глины с водой может служить примером грубодисперсной системы. Она непрозрачна, и отдельные частицы можно обнаружить при помощи обычного микроскопа.
2) Дисперсные системы различаются по тому, в каком агрегатном состоянии находятся дисперсные частицы и в какой среде они распределены. Например, в суспензиях твердые частицы находятся в жидкой среде. В эмульсиях мельчайшие капельки одной жидкости распределены в другой. Примером эмульсии может служить молоко, в котором капельки жира распределены в воде. В аэрозолях твердые или жидкие частицы распределены в газообразной среде, примером могут служить дым и туман
