- •Вопросы к экзамену по дисциплине «Сварка пластмасс пайки и склеивание материалов»
- •Агрегатные состояния вещества. Причины различия свойств веществ в твердом, жидком и газообразном состоянии.
- •Общая характеристика технологии сварки металлов и неметаллов. Основные разновидности. Достоинства и недостатки.
- •Общая характеристика технологии пайки материалов. Отличия от сварки плавлением и склеивания. Достоинства и недостатки. Примеры применения.
- •Физические состояния полимеров. Характерные участки и температурные переходы термомеханической кривой полимера.
- •Определение, состав и классификация пластмасс.
- •Термопласты. Их основные свойства как конструкционных материалов.
- •Сварка термопластов растворителем. Достоинства и недостатки. Примеры применения.
- •Контактно-тепловая сварка термопластов проплавлением. Разновидности способа. Примеры применения.
- •Контактно-тепловая сварка термопластов оплавлением. Примеры применения. Сварка прямым нагревом
- •Сварка термопластов ультразвуком. Основная схема сварочного оборудования. Основные параметры. Примеры применения.
- •Сварка термопластов трением. Основные разновидности. Основные параметры. Примеры применения.
- •Классификация клеев. Их достоинства и недостатки.
- •Эпоксидные клеи. Состав. Особенности отверждения. Свойства клеевых соединений. Области применения.
- •Типовой технологический процесс склеивания. Особенности конструирования клеевых соединений.
- •Сущность процесса пайки. Паяльный зазор. Припой. Отличия пайки от склеивания и сварки плавлением.
- •Растворение основного металла в жидком припое, его положительное и отрицательное влияние на формирование паяных соединений.
- •Классификация припоев:
- •Припои для пайки алюминия.
- •Серебряные припои. Основные области применения.
- •Медные, медно-цинковые и медно-фосфорные припои. Основные области применения.
Вопросы к экзамену по дисциплине «Сварка пластмасс пайки и склеивание материалов»
2008/2009 учебный год.
Понятие об энергии межатомного взаимодействия, ее связь со свойствами твердых тел.
. Энергия взаимодействия атомов определяется выражением:
![]()
Где А – постоянная величина;
1, 2 – коэффициенты поляризуемости;
r – расстояние между атомами.
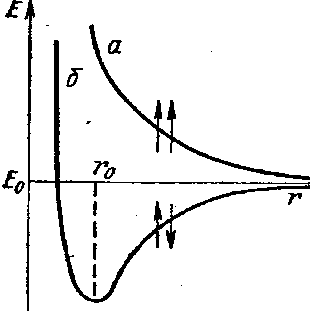
на расстояниях равных нескольким диаметрам атомов, возможно только притяжение, но не отталкивание, независимо от того, имеют или нет эти атомы электрические диполи. Дальнейшее сближение атомов до таких расстояний, когда их электронные оболочки начинают взаимодействовать, притяжение атомов всегда сменяется отталкиванием (рис. 1). Энергия взаимодействия при этом определяется структурой внешнего электронного слоя, определяя различные типы связей между атомами.
|
Рис. 1. Энергия системы, состоящей из двух атомов, а—при одинаково направленных спинах электронов; б—при противоположно направленных спинах; Е0 – энергия системы из двух невзаимодействующих атомов, r0 – межъядерное расстояние в молекуле. |
Агрегатные состояния вещества. Причины различия свойств веществ в твердом, жидком и газообразном состоянии.
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном. Четвертым агрегатным состоянием вещества часто считают плазму. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Фазовая диаграмма вещества. Связь между температурами критической, кипения, плавления и эксплуатации (для металлов).
Понятие о кристаллических и аморфных веществах.
Важной особенностью кристаллических полимеров является то, что они состоят не только из кристаллических, но и аморфных областей, между которыми трудно установить границу. Поэтому такие полимеры называют частично-кристаллическими. Одна и та же макромолекула в них может находиться в нескольких кристаллитах, проходя при этом через несколько аморфных областей. Эти проходные цепи принимают на себя основную нагрузку при деформации полимера, поэтому они главным образом ответственны за его прочность.


Рис.3. Структура неупорядоченного аморфного полимера |
Рис.4. Структура частично кристаллического полимера |
Понятие об электроотрицательности элементов. Ионная связь. Примеры веществ с ионным типом связей.
Ковалентная связь. Примеры веществ с ковалентным типом связей.
Ковалентная связь возникает, когда сближаются атомы с незавершенной электронной оболочкой. Начальный период сближения обусловлен силами Ван-дер-Ваальса. Но после перекрытия электронных оболочек начинается процесс их перестройки путем обобществления валентных электронов и образования молекулы, где электроны поочередно переходят от одного атома к другому с частотой 1018 раз/сек. Такую связь имеют атомы в двухатомных молекулах кислорода, фтора, азота и в многоатомных – аммиака, метана и других углеводородов, где общие электронные оболочки имеют не два (как у водорода), а 8 электронов.
Причины полимеризации органических мономеров.
Металлическая связь. Достоинства и недостатки металлов как конструкционных материалов.
Металлическая связь. Электроны в металлах не принадлежат к каким либо отдельным ядрам, а переходят от одного атома к другому. Кристаллическую структуру металлов можно представить в виде регулярно расположенных ионов узлов кристаллической решетки (атомов, потерявших электроны) «погруженных» в ванну из обобществленных во всем объеме металла электронов наружных орбит ранее нейтральных атомов. Положительный заряд ионов и отрицательный – электронов полностью компенсируются, и металл становится электрически нейтральным
При сварке металлов преимущественно образуются металлические связи.
Межатомная и межмолекулярная связь, обусловленная действием сил Ван-дер-Ваальса. Водородная связь. Примеры их проявления.
Классификация конструкционных материалов. Понятие о композиционных материалах.
Классификация видов соединений деталей в конструкциях. Способы создания неразъемных соединений. Преимущества способов соединения с помощью сил физико-химического сцепления.
В зависимости от конструктивных, технологических, эксплуатационных и экономических требований соединения могут быть разъемными и неразъемными. Разъемные соединения разбираются без повреждения деталей, а неразъемные соединения можно разобрать, лишь разрушая связи или детали, повреждая посадочные поверхности.
Разъемные соединения выполняют как подвижными, так и неподвижными под нагрузкой. В подвижных (под нагрузкой или без нее) соединениях возможно относительное перемещение деталей, предусмотренное функциональным назначением.
Сварные, паяные и клеевые соединения – наиболее распространенные виды неразъемных соединений элементов конструкций, обеспечивающие высокопроизводительную и экономически целесообразную сборку.