
- •1. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •5. Принцип Пауля. Емкость энергетических уровней и подуровней атомов элементов.
- •4. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •6. Связь периодического закона со строением электронных оболочек атома. Правило Клечковского. Энергетические ячейки. Правило Хунда.
- •7.Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и пи-связи. Гибридизация атомных орбиталей.
- •12. Ионная связь.
- •13. Полярность связи. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •Межмолек.Взаим-е.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •18 Стандартная энтальпия образования. Следствия из закона Гесса.Термохимич.Расчеты.
- •19. Зависимость теплового эффекта реакции от температуры (закон Кирхгоффа).
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •23. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс.
- •26. Молекулярность и порядок реакции.
- •27. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •34. Растворимость газов в жидкостях. Закон Генри. Закон Дальтона. Закон распределения.
- •30. Скорость гетерогенной химической реакции.
- •32. Катализ. Гомогенный и гетерогенный катализ.
- •32. Растворы. Растворимость. Способы выражения концентраций растворов.
- •1. Мольная доля
- •6.Нормальность
- •33. Физические и химические процессы при при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •35. Законы Рауля.
- •38.Сильные электролиты. Понятие активности и коэффициента активности.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •39.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •37. Константа диссоциации. Закон разведения Оствальда.
- •40. Гидролиз солей. Константа и степень гидролиза.
- •41. Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.
- •42.Возникновение скачка потенциала на границе “металл-раствор”. Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •44.Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •49.Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •48. Законы Фарадея. Выход по току.
- •47.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •50.Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •56. Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •57.Диаграмма плавкости непрерывно твердых растворов. Правило рычага.
- •58. Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •59. Диаграмма плавкости бинарной системы с образованием химических соединений.
55. Основные принципы построения диаграммы плавкости бинарных систем.
Сущность термографического анализа. Кривые нагревания и охлаждения.
Диаграмма состояния системы - диаграмма, указывающая, в каких фазовых состояниях находится система в зависимости от условий: температура, давление и состав.
Диаграммы плавкости – частный вид диаграмм состояния.
2 принципа, устанавливающих связь геометрических образов диаграммы с химическим состоянием системы.
1. Принцип непрерывности.
При непрерывном изменении температуры, давления, концентрации свойства отдельных фаз системы меняются также непрерывно. Свойства системы в целом изменяются непрерывно лишь до тех пор, пока не изменится число или характер ее фаз. При появлении новых или исчезновении имеющихся фаз свойства системы в целом меняются скачком.
2. Принцип соответствия.
Каждой совокупности фаз, находящихся в равновесии в данной системе, отвечает на диаграмме определенный геометрический образ.В двухкомпонентной системе одной фазе на диаграмме соответствует участок плоскости, кристаллизации твердой фазы- кривая начала кристаллизации, равновесию между тремя фазами - точка пересечения кривых, и т.д.
Т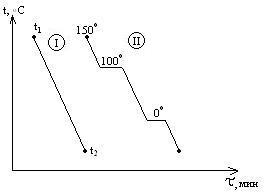
 ермографический
анализ –
кривые нагревания или кривые охлаждения
системы. Диаграммы плавкости (частный
вид диагарамм состояния) строят исходя
из кривых охлаждения, которые изображаются
в координатах: температура(Оу), время(Ох).
Рассмотрим кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых превращений,
температура меняется монотонно. Кривая
II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу – процессу
конденсации пара, температура
поддерживается неизменной, пока не
исчезнет весь пар. Постоянство температуры
обеспечивается за счёт выделения в
процессе конденсации пара теплоты
испарения воды. От 100
o
C
до 0 o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода. При
0 o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.
ермографический
анализ –
кривые нагревания или кривые охлаждения
системы. Диаграммы плавкости (частный
вид диагарамм состояния) строят исходя
из кривых охлаждения, которые изображаются
в координатах: температура(Оу), время(Ох).
Рассмотрим кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых превращений,
температура меняется монотонно. Кривая
II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу – процессу
конденсации пара, температура
поддерживается неизменной, пока не
исчезнет весь пар. Постоянство температуры
обеспечивается за счёт выделения в
процессе конденсации пара теплоты
испарения воды. От 100
o
C
до 0 o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода. При
0 o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.
Рассмотрим кривые охлаждения чистого металла (I) и сплава с так называемой эвтектикой (II). На кривой охлаждения (I) чистого металла А наблюдается одна площадка bc, отвечающая процессу кристаллизации металла. При tпл в равновесии находятся жидкая и твердая фазы одинакового состава. Образование твердой фазы сопровождается выделением теплоты плавления.
Кривая II отвечает охлаждению сплава А-В. От “а” до “a’ “ температура меняется монотонно, остывает жидкая фаза. При достижении точки a’ из жидкой фазы начинают выпадать кристаллы А – одного из компонентов сплава, при этом жидкая фаза за счет этого начнет обогащаться компонентом В. Таким образом, в интервале a’-b в равновесии находятся жидкая и твердая фазы различного состава, площадки на кривой охлаждения не наблюдается. За счет выделения при кристаллизации А теплоты плавления этого компонента темп охлаждения сплава замедляется, и на кривой наблюдается перелом. Выпадение кристаллов А продолжается до тех пор, пока жидкая фаза не достигнет так называемого “эвтектического состава”. Основной особенностью эвтектического сплава является то, что он кристаллизуется подобно чистому компоненту – на кривой охлаждения наблюдается площадка. Из жидкой фазы одновременно выпадают кристаллы А и В и, таким образом при tЕ (отрезок bc) в равновесии находятся жидкая и твердая фазы одинакового состава. Отрезок cd отвечают охлаждению твердого сплава.
Остановки в падении температуры могут наблюдаться и на кривой охлаждения уже твердого металла, указываю на переходы металла из одной аллотропной формы в другую.
