
himiya moi
.docx31. Скорость гетерогенной химической реакции. Особенности ее протекания
Гетерогенные
(многофазные) реакции происходят на
поверх-ти раздела соприкасающихся фаз.
относятся: горение топлива, окисление
металлов кислородом, растворение газа
в жидкостях. Ск-ть реакций зависит от
размеров и состояния поверхности
раздела фаз. Гетерогенные процессы
многостадийны. Кроме осн-го
процесса,обязательны стадии подвода
к этой поверх-ти исходных веществ и
отвода от нее продуктов реакции.Если
определяющей стадией является хим.реакция
на поверхности раздела фаз, то процесс
описывается законами хим.
кинетики
Если, как это обычно бывает, наиболее
медленно совершается подвод и отвод,
то процесс описывается законами диффузии
. Повышение темп-ры на каждые 100
увеличивает коэффициент диффузии на
20%, тогда как скорость реакции увеличивается
в 2-4 раза. Диффузия оказывает большое
влияние на протекание гетерогенных
процессов.1й
закон диффузии. Масса
веществ dm,
переносимого путем диффузии в направлении
х через перпендикулярную этому
направлению площадку, пропорциональна
коэффициенту диффузии D,
площади S,
времени
 и градиенту концентрации
и градиенту концентрации

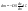 Скорость
диффузии
Скорость
диффузии

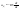 Знак
«-» указывает, что процесс диффузии
направлен в сторону понижения
концентрации.
Знак
«-» указывает, что процесс диффузии
направлен в сторону понижения
концентрации. Е – энергия активации.2й
закон диффузии выражает
зависимость изменения концентрации в
объеме одной из соприкасающихся фаз
от времени:
Е – энергия активации.2й
закон диффузии выражает
зависимость изменения концентрации в
объеме одной из соприкасающихся фаз
от времени:
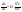 Стационарная
диффузия. При
СД концентрация меняется только с
расстоянием (х), от времени – нет.
Стационарная
диффузия. При
СД концентрация меняется только с
расстоянием (х), от времени – нет.
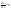 =>
=>

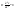 а – градиент концентрации. Эффективный
путь диффузии.при
а – градиент концентрации. Эффективный
путь диффузии.при


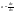
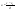
 толщина диффузионного слоя. Ур-е
стационарной диффузии.
толщина диффузионного слоя. Ур-е
стационарной диффузии.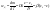
 коэффициент массопередачи
коэффициент массопередачи
 Ск-ть
растворения тв.тела в жидкостях.Поверхность
тв. тела – S,
концентрация насыщенного раствора
-
Ск-ть
растворения тв.тела в жидкостях.Поверхность
тв. тела – S,
концентрация насыщенного раствора
- конц-я
в объеме раствора -
конц-я
в объеме раствора -
 толщина
диффузионного слоя -
толщина
диффузионного слоя -
 Ск-ть
растворения значительно больше ск-ти
диффузионного переноса вещества в
объем раствора. Кол-во вещества,
растворяющегося в единицу времени, -
L.Фактически
ск-ть процесса
Ск-ть
растворения значительно больше ск-ти
диффузионного переноса вещества в
объем раствора. Кол-во вещества,
растворяющегося в единицу времени, -
L.Фактически
ск-ть процесса
 k
– константа скорости,
k
– константа скорости,
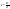 Ур-е
стационарной диффузии:
Ур-е
стационарной диффузии:
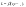
32.
Инициирование
химических реакций .Катализ. Сущность
гомогенного и гетерогенного катализа.
Инициирование-наиб
.энергоемкая стадия цепной реакции, ее
энергия активации опр энергией
разрываемой хим.св.. Катализ
- Изменение скорости реакции под
действием некоторых веществ (катализаторов)
Различают положит. катализ и антикатализ.
При катализе
ск-ть реакции увелич-ся, при антикатализе
- уменьшается.
Вещества, увеличивающие скорость
реакции-катализаторы, уменьшающ. -
ингибиторы. Как правило катализатор
при реакции не расходуется, ингибитор
расходуется. Существует также и
автокатализ - в роли катализатора
выступают продукты реакции. Пример:
FeO+H2=Fe+H2O
Катализаторы не влияют на : ∆G=
-RTlnKp
(изменение своб.энер. Гиббса системы)
реакции, следовательно и на константу
равновесия. Катализатор лишь ускоряет
наступление равновесия реакции, но не
смещает его. Для катализаторов присуща
определенная избирательность. Различают
гомогенный и гетерогенный катализ. В
первом случае реагирующие вещества и
катализатор составляют одну фазу.
Пример:
 Ск-ть
реакции прямо пропорциональна количеству
катализатора. Механизм можно объяснить
образованием промежуточных нестойких
соединений. Реакции идут с меньшей
энергией активации => быстрее. Пример:
Ск-ть
реакции прямо пропорциональна количеству
катализатора. Механизм можно объяснить
образованием промежуточных нестойких
соединений. Реакции идут с меньшей
энергией активации => быстрее. Пример:
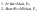 Основная
причина ускоряющего действия –
уменьшение энергии активации. Во втором
случае – разные фазы. Пример:
Основная
причина ускоряющего действия –
уменьшение энергии активации. Во втором
случае – разные фазы. Пример:
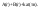 Имеет
значение не количество катализатора,
а состояние его поверхности. Катализатор
чаще всего находится в твердой фазе.
Твердые катализаторы – оксиды, сульфиды,
металлы и соли. Иногда достаточно
простого контакта для огромного
увеличения скорости. Пример.
Имеет
значение не количество катализатора,
а состояние его поверхности. Катализатор
чаще всего находится в твердой фазе.
Твердые катализаторы – оксиды, сульфиды,
металлы и соли. Иногда достаточно
простого контакта для огромного
увеличения скорости. Пример.
 при добавлении
при добавлении
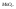 Твердые
катализаторы могут терять свою активность
под действием каталитических «ядов»
- соединений мышьяка, фосфора, цианидов,
сероводорода, ацетилена, кислорода.
Поскольку малые количества ядов способны
отравлять большие массы катализатора.
Это говорит о том, что работает не весь
катализатор, а лишь его активные центры.
Согласно теории мультиплетов,
сущ.определенные закономерности,
связывающие расстояния между атомами
и расстояния между активными центрами
катализатора. Мультиплет – активный
центр на поверхности катализатора,
состоящий из нескольких атомов или
ионов, имеющий правильную конфигурацию,
зависящую от строения всей кристаллической
решетки катализатора. Для протекания
определенной реакции молекула должна
расположиться особым образом относительно
двух активных центров. Отрицательный
катализ вызывается ингибиторами. Они
могут расходоваться при протекании
процесса. Их действие заключается в
том, что они связывают положит.
катализаторы либо мешают положительному
катализу. С помощью ингибиторов защищают
металл от коррозии в жидких средах,
тормозят окислительные процессы в
маслах и топливе.
Твердые
катализаторы могут терять свою активность
под действием каталитических «ядов»
- соединений мышьяка, фосфора, цианидов,
сероводорода, ацетилена, кислорода.
Поскольку малые количества ядов способны
отравлять большие массы катализатора.
Это говорит о том, что работает не весь
катализатор, а лишь его активные центры.
Согласно теории мультиплетов,
сущ.определенные закономерности,
связывающие расстояния между атомами
и расстояния между активными центрами
катализатора. Мультиплет – активный
центр на поверхности катализатора,
состоящий из нескольких атомов или
ионов, имеющий правильную конфигурацию,
зависящую от строения всей кристаллической
решетки катализатора. Для протекания
определенной реакции молекула должна
расположиться особым образом относительно
двух активных центров. Отрицательный
катализ вызывается ингибиторами. Они
могут расходоваться при протекании
процесса. Их действие заключается в
том, что они связывают положит.
катализаторы либо мешают положительному
катализу. С помощью ингибиторов защищают
металл от коррозии в жидких средах,
тормозят окислительные процессы в
маслах и топливе.
33. Дисперсные системы. Коллоидные растворы. Дисперсные системы - это система из двух и более в-в, которые практически не смешиваются и не реагируют друг с другом. Состоят из двух и более фаз(тел)с сильно развитой поверхностью раздела. в грубодисперсных системах частицы имеют размер от 10-4и выше, в коллоидных системах от 10-7 до 10-5-10-4. Дисп.сист. : эмульсии(масло в воде), сустензии(глина в воде),коллоидные растворы. Коллоидные растворы -высокодисперсные системы частицы интенсивно участвуют в броуновском движении(— беспорядочное движение микроскопических видимых, взвешенных в жидкости или газе частиц твердого вещества, вызываемое тепловым движением частиц жидкости или газа), заполняя весь объем дисперсной системы. Коллоидные частицы способны рассеивать свет. Коллоидные системы, в свою очередь, подразделяются на две группы, резко отличные по характеру взаимодействий между частицами дисперсной фазы и дисперсионной среды – лиофобные коллоидные растворы (золи) и растворы высокомолекулярных соединений (ВМС), которые ранее называли лиофильными коллоидами. К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов. Растворы ВМС образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Лиофобные коллоиды и растворы ВМС различаются также и структурой частиц, составляющих дисперсную фазу. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава – мицелла, для растворов ВМС – макромолекула.
34.
Растворы.
Растворимость. Способы выражения
концентраций растворов. Раствор
- гомогенная система, в которой одно
вещество равномерно распределено в
среде другого. В растворе различают
растворитель и растворяемое вещество.
Растворитель-то
в-во,к-ое в чистом виде нах-ся в той же
фазе, что и р-р. Разбавленный
раствор –
раствор, в котором содержание одного
из компонентов намного меньше содержания
другого компонента. Концентрированный
раствор -
раствор, в котором относительные
количества растворенного вещества и
растворителя одного порядка. Раствор,
находящийся в фазовом равновесии с
растворяемым веществом, наз насыщенным.
Насыщенный раствор представляет собой
самостоятельную фазу и, разумеется,
может быть отделен от осадка, оставаясь
насыщенным. Такой раствор при постоянной
температуре имеет неизменный химический
состав, а его концентрация определяется
растворимостью вещества.
пересыщенные
растворы, в
которых содержание растворенного
вещества больше, чем в насыщенном
растворе этого же вещества при тех же
значениях температуры и давления. Такие
растворы неустойчивы и при контакте с
растворенным веществом или даже без
видимого внешнего воздействия переходят
в насыщенные растворы, выделяя избыток
растворенного вещества. Ненасыщенным
называют раствор, в котором при данных
температуре и давлении возможно
дальнейшее растворение уже содержащегося
в нем вещества. Концентрация
раствора –
количественное выражение его состава.
1. Мольная
доля
N1=n1/n1+n22.
Процентная
конц-я-сколько грамм содерж-ся в 100
граммах р-ра.
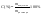 3. Концентрация,
выражаемая через плотность
раствора.Вычисляется с помощью приборов
(ареометр, пикнометр, лактометр) и
специальных таблиц значений. 4.
Молярность
3. Концентрация,
выражаемая через плотность
раствора.Вычисляется с помощью приборов
(ареометр, пикнометр, лактометр) и
специальных таблиц значений. 4.
Молярность показывает сколько молей растворенного
вещества в одном литре раствора.
показывает сколько молей растворенного
вещества в одном литре раствора.
 М – молекулярная масса вещества. 5.
Моляльность
М – молекулярная масса вещества. 5.
Моляльность показывает сколько молей растворенного
вещества приходится на 1000 грамм
растворителя
показывает сколько молей растворенного
вещества приходится на 1000 грамм
растворителя
 6.Нормальность
6.Нормальность
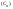 показывает сколько грамм-эквивалентов
растворенного вещества содержится в
1 литре раствора Сн=Mr
э(моль-экв)\V(л)=mr*z(масса
на число экв)(z=валентность*число
атомов)\V
7. Титр –
число граммов раствренного вещества
в 1 мл раствора.
T=m\V
(г\мл)
показывает сколько грамм-эквивалентов
растворенного вещества содержится в
1 литре раствора Сн=Mr
э(моль-экв)\V(л)=mr*z(масса
на число экв)(z=валентность*число
атомов)\V
7. Титр –
число граммов раствренного вещества
в 1 мл раствора.
T=m\V
(г\мл)
35.
Физ и
хим процессы при растворении. Растворимость
твердых тел и жидкостей в жидкостях.
Физические и химические процессы при
при растворении. Растворимость твердых
тел и жидкостей в жидкостях. Физическая
теория растворов (Вант-Гофф).
Растворитель является индифферентной
средой, в которой равномерно размешаны
молекулы растворенного вещества по
всему объему раствора. Взаимодействия
между чатицами и молекулами нет. Теория
оправдывается для разбавленных растворов
неэлектролитов.
Химическая теория растворов (Менделеев).
Растворитель
дает с растворенным веществом определенные
соединения – сольваты.
Молекулы
сольватов образуют с растворителем
молекулярную смесь.
Причина
образования сольватов – проявление
донорно-акцепторных и водородных
связей. Вокруг ионов располагаются
молекулы растворителя, образуя сольватные
слои
(оболочки). Сольваты менее прочны, чем
обычные химические соединения. Легко
разрушаются даже при небольшом повышении
температуры растворов.
Растворение
сопровождается выделением/поглощением
теплоты, сокращением/увеличением
объема.
Теплота растворения вещества
– количество теплоты, поглощаемой
(выделяемой) при растворении одного
моля вещества.
Растворимость твердых веществ в
жидкостях. Зависит
от природы твердых тел, природы
растворителя и температуры.
С повышением
температуры, как правило, растворимость
увеличивается (так как теплоты растворения
имеют отрицательные значения).
Для идеальных
растворов справедливо уравнение
Шредера:
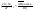 N1
– растворимость твердого вещества,
N1
– растворимость твердого вещества,
 энтальпия растворения 1 моля вещества
в насыщенном растворе.
Растворение
твердого вещества можно представить
в две стадии: плавление вещества и
смешение жидкого вещества с раствором.
Тогда энтальпия смешения равна нулю,
энтальпия растворения 1 моля вещества
в насыщенном растворе.
Растворение
твердого вещества можно представить
в две стадии: плавление вещества и
смешение жидкого вещества с раствором.
Тогда энтальпия смешения равна нулю,
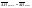 Идеальная
растворимость
увеличивается с повышением температуры
(такие системы немногочисленны).
Давление
мало влияет на растворимость твердых
веществ. При
понижении температуры происходит
выпадение вещества в осадок – процесс
кристаллизации.
Растворимость жидкостей в жидкостях.
Растворимость
увеличивается с повышением температуры
и почти не зависит от давления.
Существуют
неограниченная
растворимость и растворимость до
известного предела.
1. жидкости
смешиваются в любых пропорциях (спирт
и вода). 2.
имеет место расслаивание (образование
двух слоев – верхний и нижний). пример:
эфир и вода.
Расслаивание
уменьшается с ростом температуры и
исчезает при некоторой (критической)
температуре.
Идеальная
растворимость
увеличивается с повышением температуры
(такие системы немногочисленны).
Давление
мало влияет на растворимость твердых
веществ. При
понижении температуры происходит
выпадение вещества в осадок – процесс
кристаллизации.
Растворимость жидкостей в жидкостях.
Растворимость
увеличивается с повышением температуры
и почти не зависит от давления.
Существуют
неограниченная
растворимость и растворимость до
известного предела.
1. жидкости
смешиваются в любых пропорциях (спирт
и вода). 2.
имеет место расслаивание (образование
двух слоев – верхний и нижний). пример:
эфир и вода.
Расслаивание
уменьшается с ростом температуры и
исчезает при некоторой (критической)
температуре.
36.
Растворимость
газов в жидкостях. Закон Генри. Закон
Дальтона. Закон распределения.
Растворимость
с повышением температуры уменьшается.
Также зависит от давления, под которым
газ находится в жидкости.
Закон Генри:
растворимость газа, выраженная в весовых
единицах, при постоянной температуре
пропорциональна давлению газа над
раствором. Г – константа Генри. Закону подчиняются
газы, растворимость которых невелика
и которые не вступают в реакцию с
срастворителем (т.е. идеальный раствор).
Закон Дальтона:
общее давл-е газа в смеси равно сумме
парц.давл-й в газе. Парц.д-е-то д-е,к-ое
создавал бы данный газ, если бы он
занимал тот же объем при тех же условиях.
Закон
распределения.
Если при постоянной температуре
некоторое вещество распределяется
между двумя соприкасающимися фазами,
то отношение концентрации этого вещества
в соприкасающихся фазах есть величина
постоянная – коэффициент растворения
L. V1=k1c1
; V2=k2c2;
V1=V2;
k1c1=k2c2;
Г – константа Генри. Закону подчиняются
газы, растворимость которых невелика
и которые не вступают в реакцию с
срастворителем (т.е. идеальный раствор).
Закон Дальтона:
общее давл-е газа в смеси равно сумме
парц.давл-й в газе. Парц.д-е-то д-е,к-ое
создавал бы данный газ, если бы он
занимал тот же объем при тех же условиях.
Закон
распределения.
Если при постоянной температуре
некоторое вещество распределяется
между двумя соприкасающимися фазами,
то отношение концентрации этого вещества
в соприкасающихся фазах есть величина
постоянная – коэффициент растворения
L. V1=k1c1
; V2=k2c2;
V1=V2;
k1c1=k2c2;
 С точки зрения термодин-ки: ∆GT1=∆GT1+RTlnc1
;
∆GT2=∆GT2+RTlnc2
С точки зрения термодин-ки: ∆GT1=∆GT1+RTlnc1
;
∆GT2=∆GT2+RTlnc2
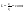 Расп-е в-ва «b»
при Т-const
остается const
независимо от общего к-ва раствор.в-ва.
L-const
распр-я-опр-ся природой в-в и темп-рой.
Если «b»-тв.в-во,то
коэф-т распр-я при ув-и темп-ры
растет,т.к.разруш-ся связи в тв.в-ве при
растворении,что сопровожд-ся эндоэффектом.В
практике этот з-н действует: 1)процессор
экстракции 2)в металлургии 3)женная
плавка4)осмос и осмотич.давл-е5)в
растениях6)обратный осмос-для опреснения
морской воды
Расп-е в-ва «b»
при Т-const
остается const
независимо от общего к-ва раствор.в-ва.
L-const
распр-я-опр-ся природой в-в и темп-рой.
Если «b»-тв.в-во,то
коэф-т распр-я при ув-и темп-ры
растет,т.к.разруш-ся связи в тв.в-ве при
растворении,что сопровожд-ся эндоэффектом.В
практике этот з-н действует: 1)процессор
экстракции 2)в металлургии 3)женная
плавка4)осмос и осмотич.давл-е5)в
растениях6)обратный осмос-для опреснения
морской воды
37.
Законы
Рауля. Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем.
Первый закон. Давление
пара растворителя над раствором
пропорционально мольной доле растворителя
в растворе.
Или относит.пониж-е
давл-я пара над р-ром равно мольной доле
раств.в-ва.
р0
– давление над чистым растворителем;
P1-давление
пара растворителя над раствором;
 абсолютное понижение давления;
абсолютное понижение давления;
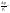 относительное понижение давления.
относительное понижение давления.

 N1
– мольная
доля раствор-ляВторой
закон. Повышение
температуры кипения раствора и понижение
температуры его замерзания пропорциональны
моляльной концентрации раствора.
∆Ткип=кэд*сm
; ∆Т=ккр*сm
кэд-эдалестич.конст.,
ккр-криастатич.конст..
Зависят только от природы р-ля. Смысл
конст: на столько градусов понизится
темп-ра замерзания или повысится темп-ра
кипения. Изм-е т-ры замерз-я и кипения
зависит от природы и моляльности р-ра.
N1
– мольная
доля раствор-ляВторой
закон. Повышение
температуры кипения раствора и понижение
температуры его замерзания пропорциональны
моляльной концентрации раствора.
∆Ткип=кэд*сm
; ∆Т=ккр*сm
кэд-эдалестич.конст.,
ккр-криастатич.конст..
Зависят только от природы р-ля. Смысл
конст: на столько градусов понизится
темп-ра замерзания или повысится темп-ра
кипения. Изм-е т-ры замерз-я и кипения
зависит от природы и моляльности р-ра.
![]()
![]() где a — число грамм растворенного
вещества на 1000 г растворителя где
где a — число грамм растворенного
вещества на 1000 г растворителя где ![]() —
энтальпия испарения(Кипения); M1 —
молярная масса растворителя; n2 — моляльная
концентрация растворенного
вещества.
Эбулиоскопия-кипение.Криоскопия-замерз.
—
энтальпия испарения(Кипения); M1 —
молярная масса растворителя; n2 — моляльная
концентрация растворенного
вещества.
Эбулиоскопия-кипение.Криоскопия-замерз.
38.Электролитическая
диссоциация. Степень диссоциации.
Слабые электролиты. Константа диссоциации.
Закон разбавления Оствальда. Электролиты
– вещества,
которые в растворе или расплаве состоят
полностью или частично из ионов. Они
не подчиняются законам Рауля: их растворы
замерзают при более низких T, а кипят
при более высоких T,
чем растворы неэлектролитов той же
моляльной концентрации. Электролитическая
диссоциация. Теория ЭД Аррениуса.
«Электролиты, растворяясь в воде,
распадаются на ионы (заряженные частицы).
При этом каждый ион ведет себя как
самостоятельная частица. В результате
диссоциации концентрация увеличивается
(число частиц в единице объема).» Каблуков
дополнил теорию ЭД: «основная причина
диссоциации на ионы – взаимодействие
с полярными молекулами воды». Согласно
закону Кулона, сила притяжения между
зарядами
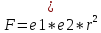
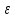 показывает, во сколько раз сила в данной
среде меньше, чем в вакууме. Об ионизирующей
способности растворителей судят по их
диэлектрической проницаемости: чем
она выше, тем энергичнее протекает
процесс ЭД. Кроме воды, электролиты
диссоциируют в
показывает, во сколько раз сила в данной
среде меньше, чем в вакууме. Об ионизирующей
способности растворителей судят по их
диэлектрической проницаемости: чем
она выше, тем энергичнее протекает
процесс ЭД. Кроме воды, электролиты
диссоциируют в
 По способности диссоциации электролиты
делятся на слабые и сильные. Сильные
диссоциируют полностью – процесс
необратим. Процесс диссоциации слабых
обратим (в растворах содержатся как
ионы, так и недиссоциированные молекулы).
Степень диссоциации - доля растворенного
электролита, распавшегося на ионы.
Сильные электролиты-α>0,7 Слабые= α<0,3
На практике СД определяют путем измерения
электропроводимости раствора. Различают
удельную электропроводимость
По способности диссоциации электролиты
делятся на слабые и сильные. Сильные
диссоциируют полностью – процесс
необратим. Процесс диссоциации слабых
обратим (в растворах содержатся как
ионы, так и недиссоциированные молекулы).
Степень диссоциации - доля растворенного
электролита, распавшегося на ионы.
Сильные электролиты-α>0,7 Слабые= α<0,3
На практике СД определяют путем измерения
электропроводимости раствора. Различают
удельную электропроводимость
 и эквивалентную
и эквивалентную

 повышается с увеличением разбавления
до некоторой предельной величины, когда
все молекулы распадаются на ионы
повышается с увеличением разбавления
до некоторой предельной величины, когда
все молекулы распадаются на ионы
 При этом предельное значение эквивалентной
электропроводимости – электропроводимость
при бесконечном разбавлении -
При этом предельное значение эквивалентной
электропроводимости – электропроводимость
при бесконечном разбавлении -
 Для слабых электролитов выполняется
Для слабых электролитов выполняется
 .Константа
диссоциации
в случае разбавленного электролита:
.Константа
диссоциации
в случае разбавленного электролита:

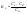 При стандартных условиях
При стандартных условиях
 Константа
диссоциации в одном и том же растворителе
при постоянной температуре – величина
постоянная, она свойственна данному
электролиту. Степень диссоциации
характеризует состояние электролита
в растворе данной концентрации и
меняется с изменением ее. При повышении
концентрации раствора
Константа
диссоциации в одном и том же растворителе
при постоянной температуре – величина
постоянная, она свойственна данному
электролиту. Степень диссоциации
характеризует состояние электролита
в растворе данной концентрации и
меняется с изменением ее. При повышении
концентрации раствора
 уменьшается.
Закон разбавления Оствальда
— соотношение, выражающее зависимость
эквивалентной электропроводности
разбавленного раствора бинарного
слабого электролита от концентрации
раствора. С разбавлением раствора
степень диссоциации его увеличивается.
Выражает зависимость между
уменьшается.
Закон разбавления Оствальда
— соотношение, выражающее зависимость
эквивалентной электропроводности
разбавленного раствора бинарного
слабого электролита от концентрации
раствора. С разбавлением раствора
степень диссоциации его увеличивается.
Выражает зависимость между

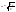 Также
можно установить связь и между
Также
можно установить связь и между

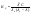 Сильные
электролиты: почти все соли, большинство
кислот и гидроксиды металлов. Электролиты
средней силы:
Сильные
электролиты: почти все соли, большинство
кислот и гидроксиды металлов. Электролиты
средней силы:
 Слабые электролиты: почти все органические
кислоты, вода.
Слабые электролиты: почти все органические
кислоты, вода.
39. Сильные электролиты. Понятие активности и коэффициента активности.
Электролиты – вещества, которые в растворе или расплаве состоят полностью или частично из ионов. Сильные диссоциируют полностью – процесс необратим. Процесс диссоциации слабых обратим (в растворах содержатся как ионы, так и недиссоциированные молекулы). К сильным электролитам относ-ся почти все соли, кислоты (азотная, серная, галогенводород., хлорная), гидроксиды щелочн.метт. В сильных элетролитах нельзя искл-ть ионного взаим-я в р-ре, поэтому вводятся понятия «активность иона», как эффективности иона и неактивного иона. a=f*c(с-конц.,f-коэф. активностит) В оч. сильных разбавленных электролитах коэф-т активности стремится к 0, а=с,т.е. полностью проявл-ся без образ-я ионных пар. Если р-р концентрир.,то происходит броун.дв-е, ионные пары обр-ся и коэф-т акт-ти уменьш-ся. В сильных неразбавл.электр-ах обр-ся ионные пары, поэтому за счет ионных пар коэф-т активности и конц-я уменьш.
40.
Электролитическая диссоциация воды.
Ионное произведение воды. Водородный
показатель. Понятие об индикаторах.
Электролиты
– вещ-ва, которые в растворе или расплаве
состоят полностью или частично из
ионов. Они не подчиняются законам Рауля:
их растворы замерзают при более низких
темп-рах, а кипят при более высоких
темп-рах. «Электролиты,
растворяясть в воде, распадаются на
ионы (заряженные частицы). При этом
каждый ион ведет себя как самост.
частица.В результате диссоциации
концентрация увелич-ся).»
Ио́нное произведе́ние воды́
— произведение концентраций ионов
водорода Н+ и ионов гидроксила OH− в
воде или в водных растворах, константа
автопротолиза воды. Экспериментально
установлено, что произведение
концентраций ионов H+ и OH¯
в воде и разбавленных водных растворах
электролитов является величиной
постоянной и называется ионным
произведением воды (Kw) Равновесие этой
реакции сильно смещено влево. Константу
диссоциации воды можно вычислить по
формуле:
![]() где: [H+] —
концентрация ионов гидроксония
(протонов); [OH−] — концентрация
гидроксид-ионов; [H2O] — концентрация
воды (в молекулярной форме) в воде;
Индика́тор
(лат. indicator – указатель) — соединение,
позволяющее визуализировать изменение
концентрации какого-либо вещества или
компонента, например, в растворе при
титровании, или быстро определить pH,
еН и др. параметры. Водоро́дный
показа́тель, pH (произносится
«пэ аш», английское произношение англ.
pH — piː'eɪtʃ «Пи эйч») — мера активности
(в очень разбавленных растворах она
эквивалентна концентрации) ионов
водорода в растворе, и количественно
выражающая его кислотность, вычисляется
как отрицательный (взятый с обратным
знаком) десятичный логарифм активности
водородных ионов, выраженной в молях
на литр:
где: [H+] —
концентрация ионов гидроксония
(протонов); [OH−] — концентрация
гидроксид-ионов; [H2O] — концентрация
воды (в молекулярной форме) в воде;
Индика́тор
(лат. indicator – указатель) — соединение,
позволяющее визуализировать изменение
концентрации какого-либо вещества или
компонента, например, в растворе при
титровании, или быстро определить pH,
еН и др. параметры. Водоро́дный
показа́тель, pH (произносится
«пэ аш», английское произношение англ.
pH — piː'eɪtʃ «Пи эйч») — мера активности
(в очень разбавленных растворах она
эквивалентна концентрации) ионов
водорода в растворе, и количественно
выражающая его кислотность, вычисляется
как отрицательный (взятый с обратным
знаком) десятичный логарифм активности
водородных ионов, выраженной в молях
на литр:
![]() В зависимости от соотношения концентраций
ионов H+ и OH¯ различают три
вида реакции
среды:
кислая среда: [H+] > [OH¯]; [H+] > 10-7 моль/л;
pH < pOH; pH < 7; нейтральная среда: [H+] =
[OH¯] = 10-7 моль/л; pH = pOH = 7; щелочная среда:
[H+] < [OH¯]; [H+] < 10-7 моль/л; pH > pOH; pH >7;
В зависимости от соотношения концентраций
ионов H+ и OH¯ различают три
вида реакции
среды:
кислая среда: [H+] > [OH¯]; [H+] > 10-7 моль/л;
pH < pOH; pH < 7; нейтральная среда: [H+] =
[OH¯] = 10-7 моль/л; pH = pOH = 7; щелочная среда:
[H+] < [OH¯]; [H+] < 10-7 моль/л; pH > pOH; pH >7;
41.
Гидролиз
солей. Константа и степень гидролиза
Гидролиз -
разложение солей под действием воды.
Вторая
формулировка.
Процесс, обратный нейтрализации,
приводящий к образованию кислоты и
основания. Нейтрализация
– реакция между кислотой и основанием.1.
Гидролиза нет
-если сильное
основание и сильная кислота.
-если
нерастворимые вещества («н» в таблице).
Пример.
 2. Полный
гидролиз
-если слабая
кислота и слабое основание.
-если «-» в
таблице растворимости.
Пример.
2. Полный
гидролиз
-если слабая
кислота и слабое основание.
-если «-» в
таблице растворимости.
Пример.
 3.
-если сильное основание и слабая кислота.
-если слабое
основание и сильная кислота.
Пример.
3.
-если сильное основание и слабая кислота.
-если слабое
основание и сильная кислота.
Пример.
 Константа гидролиза:
Константа гидролиза:
 Константа гидролиза —
константа равновесия гидролитической
реакции.
Степень гидролиза
– применяется для характеристики
реакций гидролиза.
Константа гидролиза —
константа равновесия гидролитической
реакции.
Степень гидролиза
– применяется для характеристики
реакций гидролиза.
 Степень возрастает
с ростом температуры и с уменьшением
концентрации (разбавлением).
Степень возрастает
с ростом температуры и с уменьшением
концентрации (разбавлением).
42.
Произведение
растворимости. произведение
концентрации ионов малорастворимого
электролита в его насыщенном растворе
при постоянной температуре и давлении.
Произведение растворимости — величина
постоянная.
При постоянной
температуре в насыщенных водных
растворах малорастворимых электролитов
устанавливается равновесие между
твердым веществом и ионами, образующими
это вещество. Например, в случае для
CaCO3
это равновесие можно записать в виде:
![]() Константа
этого равновесия рассчитывается по
уравнению:
Константа
этого равновесия рассчитывается по
уравнению:
![]() В приближении
идеального раствора с учетом того, что
активность чистого компонента равна
единице, уравнение упрощается до
выражения:
В приближении
идеального раствора с учетом того, что
активность чистого компонента равна
единице, уравнение упрощается до
выражения:
![]() Константа
равновесия такого процесса называется
произведением растворимости.
В общем виде,
произведение растворимости для вещества
с формулой :AmBn,
которое
диссоциирует на m ионов An+ и n ионов Bm-,
рассчитывается по
уравнению:
Константа
равновесия такого процесса называется
произведением растворимости.
В общем виде,
произведение растворимости для вещества
с формулой :AmBn,
которое
диссоциирует на m ионов An+ и n ионов Bm-,
рассчитывается по
уравнению:
![]() где [An+] и
[Bm-] — равновесные молярные концентрации
ионов, образующихся при электролитической
диссоциации. Из произведений растворимости
можно рассчитать концентрации катионов
и анионов в растворе малорастворимого
электролита. Значения произведений
растворимости приведены в справочниках.
Условие
выпадения осадка только одно: произведение
концентраций соответствующих ионов в
степенях стехиометрических коэффициентов
больше, чем произведение растворимости
соли при данной температуре.
где [An+] и
[Bm-] — равновесные молярные концентрации
ионов, образующихся при электролитической
диссоциации. Из произведений растворимости
можно рассчитать концентрации катионов
и анионов в растворе малорастворимого
электролита. Значения произведений
растворимости приведены в справочниках.
Условие
выпадения осадка только одно: произведение
концентраций соответствующих ионов в
степенях стехиометрических коэффициентов
больше, чем произведение растворимости
соли при данной температуре.
43.
ОВР.
Ионно-электронный метод подбора
коэффициентов в ОВР.Любая ОВР состоит
из процессов окисления и
восстановления.Окисление
– отдача электронов веществом, т.е
повышение степени окисления
элемента.Пример.
 Вещества,
отдающие электроны, называют
восстановителями.Типичные восстановители:
водород, металлы, углерод.Восстановление
– смещение электронов к веществу или
понижение степени окисления.Пример.
Вещества,
отдающие электроны, называют
восстановителями.Типичные восстановители:
водород, металлы, углерод.Восстановление
– смещение электронов к веществу или
понижение степени окисления.Пример.
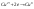 Вещества,
принимающие электроны, называют
окислителями.Типичные окислители:
галогены, водород, соединения кислорода
Вещества,
принимающие электроны, называют
окислителями.Типичные окислители:
галогены, водород, соединения кислорода
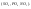 Существуют
реакции межмолекулярные (окислители
и восстановители – разные вещества) и
внутримолекулярные (окислители и
восстановители – атомы одной молекулы).
Ионно-электронный метод подбора
коэффициентов в ОВР.1. Осуществить
материальный баланс с помощью ионов
Существуют
реакции межмолекулярные (окислители
и восстановители – разные вещества) и
внутримолекулярные (окислители и
восстановители – атомы одной молекулы).
Ионно-электронный метод подбора
коэффициентов в ОВР.1. Осуществить
материальный баланс с помощью ионов
 2.
Установить баланс с помощью зарядов.3.
Полученные 2 уравнения просуммировать
так, чтобы число отданных электронов
равнялось числу принятых.4. Получается
ионное уравнение ОВР. Перенести
коэффициенты из ионного уравнения в
молекулярное.5. Уравнять ионы, не
участвовавшие в схеме.Пример.
2.
Установить баланс с помощью зарядов.3.
Полученные 2 уравнения просуммировать
так, чтобы число отданных электронов
равнялось числу принятых.4. Получается
ионное уравнение ОВР. Перенести
коэффициенты из ионного уравнения в
молекулярное.5. Уравнять ионы, не
участвовавшие в схеме.Пример.
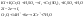

44.
Возникновения
скачка потенциала на границе раздела
«металл-раствор». Равновесный электродный
потенциал. Электрохимия – область
физической химии, охватывающая химические
процессы, сопровождающиеся возникновением
электрического тока, либо вызванные
действием электрического тока. Электрод
– проводник 1 рода, погруженный в раствор
электролита в условиях прохождения
через него тока. В объеме металла
устанавливается подвижное равновесие:
Ме=Men++
n*ē.
При погружении электрода в воду катионы
металла гидратируются полярными
молекулами воды и переходят в раствор,
Men++
mH2O=Meрn+m*H2O.
Поверхность электрода заряжается
отрицательно за счет оставшихся
электронов, из-за этого перешедшие в
раствор катионы не могут отойти от
электрода. Катионы и электроны создают
двойной
электрический слой
(его толщина зависит от концентрации
раствора, температуры, заряда металла).
Пограничный слой жидкости заряжается
положительно, поверхность металла
отрицательно, возникает скачок
электрического потенциала – электродный
потенциал.
Потенциал, отвечающий состоянию
равновесия, когда скорость перехода
ионов в раствор равна скорости их
осаждения – равновесный
потенциал.
Для всех металлов, погружаемых в чистую
воду, качественно наблюдается одинаковая
картина: металл заряжается отрицательно,
прилегающий слой жидкости – положительно.
Данный скачок можно охарактеризовать
реакцией:
![]() Рассмотрим
погружение в раствор активного и
неактивного металла.1. Активный металл
посылает большое число ионов в раствор,
равновесная концентрация его ионов
трудно достижима => металл будет
заряжаться отрицательно.2.
Равновесная концентрация очень мала
=> электроду сообщается положительный
заряд, а оставшиеся анионы создают
отрицательный заряд у прилегающего
слоя.
Рассмотрим
погружение в раствор активного и
неактивного металла.1. Активный металл
посылает большое число ионов в раствор,
равновесная концентрация его ионов
трудно достижима => металл будет
заряжаться отрицательно.2.
Равновесная концентрация очень мала
=> электроду сообщается положительный
заряд, а оставшиеся анионы создают
отрицательный заряд у прилегающего
слоя.
