
himia_shpora_mini-1_rewrite
.doc|
1)Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали. Атомные частицы обладают одновременно и корпускулярными, и волновыми св-ми. Луи де Бройль p=mv длина волны h/mv h-постоянная Планка 6.6 *1034 Дж*с. Волновые св-ва: дифракция и интерференция. Корпускулярные св-ва: электрон действует как частица, как единое целое. Движ.–пульсирующее. Сост.любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел: n, l, m, s.Гл.кв.ч.характеризует общий уровень эн.эл-на. Принимает знач. от 1 до 7 (соотв.буквенным обозначениям: k,l,m,n,o,p,q).Эл-е уровни подразделяются на подуровни. Эл-ны одного и того же подуровня различны по величине момента кол-ва дв-я mvr ( r – радиус орбиты).Число подуровней=числу уровн(макс.ч.подуровней–4).Побочное (орбитальное)кв.число хар-ет энергетич.сост. электрона на подуровне (l=n-1).Магн.к.ч.опр. ориентацию эл-го облака в пространстве (+3,+2,+1,0, -1, -2, -3).Спиновое к.ч. характеризует напр.вр-я электрона. (+1/2 и -1/2). Наиб.ч. эл-ов на подуровне вычисл.по формуле 2n2.макс.число – 32. Распр.эл-ов по уровням и подуровням изобр. с помощью электронных формул или ячеек. Пример: Mg-1s22s22p63s2. |
2) Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов. Принцип Паули: в атоме не может быть 2 электронов с одинаковым набором всех 4 к.ч. У двух электронов могут быть попарно одинаковыми 3 числа, но они обязаны различаться по четвертому. Наибольшее
число электронов Z
в оболочке с главным квантовым числом.
Максимальное число электронов на одном уровне известных ныне электронов – 32. Ограничение принципа Паули: внешний электронный уровень атомов (кроме элемента №46 – палладий) может состоять максимум из двух подуровней – S и P. То
есть максимально возможное число
электронов на внешнем уровне отвечает
конфигурации
На s-2, на p(3орбиты)-6, на d(5орбит)-10, на f(7орбит)-14эл-ов |
3) Связь периодич-го з. со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. ячейки. Правило Хунда. Д. Менделеев открыл закон в 1869 году, сформулировав его: «Св-ва простых тел, а также формы и св-ва соединений элементов находятся в периодической зависимости от величины атомных весов эл-ов.»В 1869 было известно всего 63 эл-та, в наст.вр.– 109. Периодич.сист.– по сути изобр.периодич.закона. Период – послед-ть атомов с одинаковым числом эл.слоев.Электроны заполняют при застройке оболочек наиболее выгодные в эн-м отношении подуровни. 1-ое правило Клечковского, последовательное заполнение электрон.орбиталей происходит от орбиталей с меньшим знач.суммы n+1 к большим знач.этой суммы. 2-ое правило Клечковского: при одинаковом знач.суммы заполнение происх.в напр.увелич. «n».Порядок заполнения атомных орбиталей: 1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-6s2-5d1-4f14-5d2-10-6p6-7s2-6d1-5f14-6d2-10-7p6. Периодич.сист.полностью отражает прядок заполнения эл-ми эн.уровней атомов любых эл-ов.Правило Гунда: суммарный спин данного подуровня должен быть макс., т.е. электроны стремятся занять макс.число св.кв.сост.. |
|
4) Периодич.з.Д.И.Менделеева и периодич.сист. эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та. в 1869 сформулировав его: «Св-ва простых тел, а также формы и св-ва соед.эл-ов находятся в периодич.зависимости от величины атомных весов эл-ов.» В 1869 было известно всего 63 элемента, в настоящее время – 109. Периодич.сист.– по сути изобр.периодич.з.. В наст.вр.предложено несколько вариантов сист.,но мы рассмотрим более традиционную, предложенную Менделеевым.Она имеет 3 малых периода (1-3) и 4 больших (4-7). Период – последовательность атомов с одинаковым числом эл-ных слоев.Большие периоды содержать 2 ряда (четный и нечетный). Периоды нач-ся с активн.ме,по мере продвиж. ус-ся неметалл.св-ва, а завершаются галогеном и инертным газом.Эл-ты, которые осущ. переход от ме к неме,наз-ся переходными. Эл-ты группы проявляют одинаковую макс.валентность по кислороду, равную номеру группы.Элементы гл.подгрупп проявляют опр.валентность по водороду. В главных подгруппах по мере движ.вниз металл.св-ва усиливаются, побочных – ослабевают. |
5) Периодич.изм.св-в хим.эл-ов. Радиус атомов, сродство к эл-ну, Е ионизации, электроотриц-ть. Период – последовательность атомов с одинаковым числом эл-ных слоев. Большие
периоды содержать 2 ряда (четный и
нечетный). Периоды нач-ся с активного
ме, по мере продвижения усиливаются
неме св-ва,а завершаются галогеном и
инертным газом. Эл-ты, которые
осущ.переход от ме к неме,наз-ся
переходными.Радиус
атома
- расстояние м/у атомным ядром и самой
дальней из стабильных орбит электронов
в эл.оболочке этого атома. Увелич.с
увелич.порядкового номера элемента.
Эн.ионизации
– эн.которую необх. затратить на отрыв
электрона с нормального уровня и
удаление его на далекий уровень. Атом
при этом превращ.в положит.ион.можно
счит.мерой металличности: чем меньше
энергия, тем ярче проявляются
металлические свойства, и
наоборот.Эн.сродства
к электрону
– эн., которая выделяется при
присоед.лектрона к нейтральному
атому.Она очень мала и становится
заметной с элементов 5-й
группы.Электроотр.–эн.ионизации
+энергии сродства. Чем она больше, тем
вероятнее превращение атомов в
отрицат.ионы. ЭО возрастает по периоду
и уменьшается по группе.
|
6) Образование химической связи. Энергия и длина связи. При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию молекулы/иона/кристалла. Чем прочнее связь, тем больше требуется затратить энергии на ее разрыв. При возникновении связи энергия выделяется, следовательно уменьшается потенциальная энергия системы электронов и ядер.
Потенциальная
эн. образующейся молекулы меньше
суммарной потенциальной эн.исходных
свободных атомов.Для характеристики
химической связи используются следующие
термины: Длина
связи
- межъядерное расстояние в невозбуждённой
молекуле (обычно 1-2 Ангстрема, 1А=
|
|
7) Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
К.с.
возникает м/у элементами с одинаковым
или близким знач-ми эн.сродства к
электрону. Валентность атомов в
соединениях с к.св.опр.по числу
электронных пар(1пара–1ед.валентности).Для
оценки отн.зарядности элемента в
ков.соед-х (на самом деле никаких
зарядов в этих соед-х нет) прибегают
к приему: мысленно связь разорвать
,при разрыве связи в пределах периода
электрон смещается от левее стоящего
элемента к правее стоящего, а в пределах
гл.подгр.от ниже стоящему к выше.2
метода
объяснения механизма возн-ния ков.св.:
метод валентных связей (МВС) и метод
молекулярных орбиталей (МMО).В
основе МВС лежит 3 положения: 1. Химическая
связь образуется двумя электронами
с противоположно направленными
спинами. При этом имеет место взаимное
перекрытие электронных орбиталей.
М/у атомами возникает зона повышенной
электронной плотности, к которой
притягиваются ядра с остальными
электронами.
2. Связь имеет ориентацию в направлении, обеспечивающем макс.возможное перекрывание орбиталей.3.Чем больше взаимное перекрывание эл-ных орбиталей, тем прочнее связь.Валентными являются неспаренные электроны. Их число можно изобр.c помощью эл-ной конфигурации атомов.При возб-и атомов (за счет притока эн.извне) имеет место «распаривание» электронов и переход электрона на более удалённый подуровень в пределах одного уровня. Распаривание одной электронной пары может увеличить валентность на 2 единицы. |
8)
. Направленность ков.св.. Сигма и
пи-связи. Гибридизация атомных
орбиталей. К.с.
возникает м/у элементами с одинаковым
или близким знач-м эн.сродства к
эл-ну.Перекрывание облаков при обр-нии
к.с. возможно только при опред.их
взаимной ориентации в пространстве
– отсюда направл-ть связей, приводящая
к опред. форме молекул. При этом обл.
перекрывания расп-ся опр-м обр-м по
отн-ю к взаимодейств-м атомам. 1.Молекулы
типа AA,
BB,
АВ.Характерен
для водорода, галогенов и соед.
«галоген+водород». Молекулы имеют
линейчатую структуру. Хим.св. действ.по
кратчайш.расстоянию(сигма-связь).2.Молекулы
типа A2B.Характерен
для
соед., образ-х элем-ми главной подгруппы
6-ой группы: Н2О, Н2S,H2O-валентный
угол 1050H2S-валентный
угол92033’
3.
Молекулы типаA3B.
Характерен для
соед., образ-х элем-ми гл.подгр.5-й группы
(N,
P,
As,
Sb,
Bi).Мол-ла
аммиака (NH3)
имеет форму пирамиду с треуг-м
основании.4.Молекулы
типа A4B.
Гл.подгр.4-й
гр.(Si,C,Ge,Sn,
Pb)Молекула
метана имеет форму тетраэдра (по
вершинам – атомы водорода, атом
углерода –в центре).5.
Молекулы типа AB3.Гл.подгруппа
3-ей гр.(B,Al,Ga,In,
Tl).
Мол-лаBCl3имеет
вид равностор.треуг-ка.6.Мол-лы
типа AB2.Хар-рен
для некоторых соед., образ-ми элем-ми
гл.подгруппы 2гр.. ВеCl2(линейн.структура,
угол–180).Если в мол-ле имеется кратная
связь м/у атомами (2-ная или 3-ная),то
только одна связь яв-ся
прочной-пи-связь.Остальные–сигма-связи.
Пример.Рассм.
мол-лу этилена (С2Н4).
неполная гибридизация
|
9) Ионная (электронная связь).
В
случае возникновения ионной связи
между атомами или группами атомов
преобладает электростатическое
взаимодействие. Она возникает
между атомами элементов, значительно
отличающихся по величине
электроотрицательности. Элементы, входящие в состав ионного соединения, всегда существуют в виде ионов, а не нейтральных атомов. Также нужно отметить, что полного разделения зарядов нет и имеет место частичная ковалентность.Валентность в ионных соединениях определяется по числу зарядов слагающих их ионов.Ионы проводят электр. ток в растворах и расплавах и являются проводниками второго рода.
|
|
10) Представление о методе молекулярных орбиталей. Основаны на том, что для каждого из электронных состояний молекулы как многоэлектронной системы полная волновая ф-ция составляется из произведений волновых ф-ций электронов (мол. орбита-лей) в соответствии с электронной конфигурацией системы, т. е. с учетом чисел заполнения (1 или 2). Числа заполнения при этом показывают, сколько электронов-один или два-занимают данную орбиталь, так что данная орбиталь входит в произведение один или два раза. Поскольку, согласно Паули принципу. полная волновая ф-ция системы электронов должна быть антисимметрична относительно перестановок индексов (номеров) электронов, ее представляют в виде определителя (или линейной комбинации неск. определителей), построенного из мол. спин-орбиталей и называемого о п р е д е л и т е л е м С л е й т е р а (Слэтера). |
11)
Полярность связи. Полярность молекул
и дипольный момент.Предположим,
что мы имеем соединение АB. Оба элемента
с большими знач-миэлектроотрицательности
(
l–плечо
диполя. Примеры полярных молекул-диполей:
|
12)
Донорно-акцепторный механизм ков.св..
Комплексные соединения.Донорно-акцепторная
связь (ДАС) – разновидность ковалентной
связи. Выделяют соед.1-го
порядка(или
валентно-насыщенные соед.) Пример:
H2O, AgCl, NH3, HCl, KJ, CuSO4, FeCl3 и т.д. Реагируя
друг с другом дают соед.высшего
порядка (или компл.соед.).
Азот
в NH3
– донор, водород в HCl–акцептор.
Компл.соед.–соед.высшего
порядка, возн-е из соед-й1-го порядка
без образования новых электронных
пар, а за счет проявления хотя бы одной
ДАС. Предложено 2
теории возникн-я компл.соед-й.1-я–Полин–теория
вал-х св-й.
Комлексообразователь,координирующий
лиганды вокруг себя, имеет вакантные
орбитали.Т.е.образ-е компл.соед-1–результат
проявления ДАС,Вторая–Бете теория
кристаллического поля.Связь
в комплексах–электростатич-я,т.е.
взаимод. типа
«ион-ион»или«ион-диполь». |
|
13) Межмолекулярное взаимодействие. Водородная связь.Водородная связь наблюдается при взаимодействии атома водорода с атомами сильно электроотрицательных элементов–F,O,N,Cl,S.Природа этой связи до конца не изучена: проявление сил межмолекулярного взаимодействия, но характер сил – электростатический.В случае возникновения водородной связи водород ведет себя как двухвалентный элемент.Наличие водородных связей объясняет так называемые аномальные свойства воды:1. макс. плотность при температуре +4. 2. вода обладает наибольшей теплоемкостью из известных жидкостей. При
нагреве воды значительная часть
энергии затрачивается на разрыв
связей, отсюда и повышенная
теплоемкость.Между молекулами в газах,
жидкостях и твердых телах действуют
одновременно силы отталкивания и
притяжения.Проявление сил отталкивания
– результат взаимодействия заполненных
электронных оболочек, эти силы действуют
на очень малых расстояниях и быстро
убывают с увеличением расстояния. |
14) Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия. Система - это тело или группа тел, находящихся в взаимодействии, которые мысленно выделены из окружающей среды. Бывают гомогенными (однородные) и гетерогенными (неоднородные). Изолированная система не имеет обмена веществом и энергией с окружающей средой. Закрытая – не имеет только массообмена. Открытая – имеет и энерго- и массообмен. Фаза - совокупность всех гомогенных частей системы, одинаковых по составу и всем физ. и хим. свойствам, не зависящим от количества вещества. Фазы отделены друг от друга поверхностями раздела, на которых все свойства фазы резко скачком меняются. Компоненты – сост-е части системы, химически индивидуальные вещества, составляющие данную систему и способные к самостоятельному существованию, будучи изолироваными от других частей системы. Состояние системы определяется набором переменных величин - параметров. Различают параметры интенсивные и экстенсивные. Интенсивные - не зависят от массы или числа частиц в-ва. (P,T), а экстенсивные - зависят (V, E).
Функции
состояния - это термодинамические
функции, значения которых зависят
только от состояния системы и не
зависят от пути по которому система
пришла в данное состояние. Изменение
функции состояния
Наиболее
важными функциями являются внутренняя
энергия
системы U и энтальпия
(теплосодержание)
Внутр. энергия – общий запас энергии : энергия поступательного и вращательного движения, энергия колебаний, внутриядерная энергия, за исключением кинетической энергии системы в целом и потенциальной энергии положения системы. Большое количество характеристик в химии зависят от условий, при которых они определяются. Наиболее общими и важными условиями являются температура и давление.
Стандартное
давление -
Стандартная температура – 298 К.
|
15) Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты. Существует множество формулировок первого закона:
В
изолированной
системе общий запас энергии сохраняется
постоянным.Поскольку
работа является одной из форм перехода
энергии, то, следовательно, невозможно
создание вечного двигателя первого
рода (машины, совершающей работу без
затраты энергии).Математическая
формулировка:
При протекании изохорического процесса:
При протекании изотермического процесса:
При протекании кругового процесса:
Термохимия – область физич.химии, занимающаяся изучением эн-х эффектов реакций.Если в уравнении указан ее энергетич-й эффект – это термохимическое ур-е.
V=const,
p=const,
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции. Этот закон – прямое следствие первого закона термодинамики. С помощью закона Гесса можно вычислять теплоты различных реакций, не проводя самих реакций.
Например:
Вывод: теплота испарения одного моля воды равна 44 Дж. |
|
16)Стандартная энтальпия образования. Следствия из закона Гесса.Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.Следствия из закона Гесса:1. тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции.Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов.Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ.ю отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении. 2. тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции.В настоящее время известны теплоты образования свыше 6000 веществ.Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм. |
17)
Зависимость теплового эффекта
химической реакции от температуры
(закон Кирхгофа).Температурный
коэффициент теплового эффекта процесса
равен изменению теплоемкости системы,
происходящему в результате процесса
(закон Кирхгоффа). Чтобы подсчитать тепловой эффект процесса при некоторой температуре Т2, нужно знать тепловой эффект процесса при Т1, а также характер изменения теплоемкости системы в интервале температур Т1-Т2. Обычно в роли Т1 выступает стандартная температура 298К.
|
18)
Второе начало термодинамики. Понятие
об энтропии. Расчет энтропии. Невозможен
самопроизвольный переход тепла от
менее нагретого тела более
нагретому.Невозможно
создание вечного двигателя 2го
рода(машины, которая периодически
превращает тепло среды при пост.температуре
в работу.Термодинамич-й КПД:
|
|
19) |
20
Объединенная формула первого и второго
начала термодинамики. Свободная
энергия Гиббса и Гельмгольца.Первый
закон.Теплота,
подведенная к системе, расходуется
на приращение внутренней энергии
системы и на работу системы над
окружающей средой. |
21 |
|
22 Условия самопроизвольного протекания химических реакций.В химических системах вещества стремятся к минимуму внутренней энергии. Экзотермические реакции протекают самопроизвольно, так как вещества при их окончании достигают свой минимум внутренней энергии. Но также самопроизвольно протекают и эндотермические реакции - это растворение солей.Макросостояние системы тем более вероятно, чем большим числом микросостояний оно может быть описано.Условия самопроизвольного протекания реакций: 1. стремление системы к достижению минимального значения внутренней энергии 2. стремление системы к более вероятному своему состоянию.Но часто происходит столкновение этих двух определяющих факторов , и возникает состояние называемое химическим равновесием. Функция, которая учитывает оба этих фактора – энергия Гиббса.Самопроизвольно протекают те процессы , энергия Гиббса которых равна отрицательному значению.Если температура мала , то энтальпия равна энергии Гиббса и самопроизвольно протекают экзотермические реакции.Если высокая температура , то отрицательное значение имеет энергия Гиббса и реакции протекают самопроизвольно. Необратимые реакции протекают до полного израсходования одного из реагентов. Обратимые протекают во взаимопротивоположных направлениях .В состоянии химического равновесия система достигает своего минимального значения энергии и энергия Гиббса, как и константа химического равновесия, равна нулю.
|
23 Изотерма химической реакции. Стандартное изменение свободной энергии. Энтропия. Все материальные системы обнаруживают тенденцию к достижению максимального беспорядка. Если обратиться к приведенному выше примеру с горением метана, то мы убедимся, что изменение энтальпии намного превышает изменение энтропии. Таким образом, движущей силой рассматриваемой реакции является изменение энтальпии. Однако в эндотермических реакциях преобладающую роль играет изменение энтропии. Эти реакции протекают самопроизвольно, несмотря на то что система поглощает энергию. Каким же образом следует сбалансировать между собой оба указанных выше фактора, т. е. учесть одновременно действие каждого из них? Это позволяет сделать особая термодинамическая функция состояния, которая называется свободной энергией или функцией Гиббса и обозначается буквой G. Функция Гиббса определяется с помощью уравнения (21), которое в более общем виде записывается так: ΔG = ΔH – T ΔS Таким образом, изменение свободной энергии Гиббса учитывает изменение энтальпии и изменение энтропии реакционной системы. Отметим, что энтропийный член включает в качестве множителя абсолютную температуру. Этот множитель позволяет учесть, что при высоких температурах материальные системы более раз-упорядочены, чем при низких температурах. ΔG=RT(ln(pd*pc/pa*pb)-ln(Kp))
|
24
Константа химического равновесия.
Расчет Кр, Кс, Рассмотрим
гомогенную хим.р-ю: |
|
25 Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции). Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
и изохоры химической реакции (изохоры Вант-Гоффа):
Здесь
ΔH
и ΔU —
тепловой
эффект
реакции, протекающей, соответственно,
при постоянном давлении или при
постоянном объёме. Если ΔH
> 0 (тепловой эффект положителен,
реакция эндотермическая),
то температурный коэффициент константы
равновесия
|
26
Принцип Ле-Шателье.При
неизменных условиях химическое
равновесие в системе может сохраняться
сколь угодно долго. В случае же изменения
условий (концентрация, температура,
давление) одна из противоположно
направленных реакций может ускориться,
чем другая. После этого равновесие
сместится, и установится новое состояние
равновесия.Принцип
Ле-Шателье: если
на систему, находящуюся в истинном
химическом равновесии, оказывают
воздействие извне путем изменения
какого-либо из условий, определяющих
положение равновесия, то оно смещается
в направлении той реакции, протекание
которой ослабляет эффект произведенного
воздействия.1.
Влияние температуры.Повышение
температуры смещает равновесие в
сторону процесса, идущего с поглощением
тепла. |
27
Скорость химической реакции. Закон
действующих масс. Константа
скорости.Скорость
гомогенной
(однофазной) реакции зависит от природы
реагирующих веществ, их концентрации
и температуры.Скорость гетерогенных
(многофазных) процессов зависят от
размеров и состояния поверхности
раздела фаз.Примечание.
Гетерогенные – процессы, происходящие
на поверхности раздела соприкасающихся
фаз. (горение топлива, окисление
металлом кислородом воздуха).Закон
действующих масс.Справедлив
для гомогенных реакций.Формулировка:
при
постоянной температуре скорость
химической реакции пропорциональна
произведению концентраций реагирующих
веществ.Константа скорости обозначается
как
|
|
28 |
29
Кинетическая классификация по степени
сложности. Обратимые и необратимые
реакции.По
степени сложности реакции подразделяются
на изолированные, параллельные,
сопряженные, последовательные
(многоступенчатые), обратимые и
необратимые. Изолированные
– при их протекании образуются продукты
только одного типа.Параллельные
– в ходе них взятые вещества одновременно
реагируют в двух или более направлениях
(образуются разные продукты).Пример.
Разложение бертолетовой соли
|
30
Зависимость скорости реакции от
температуры. Правило Вант-Гоффа.
Уравнение Аррениуса.Согласно
правилу
Вант-Гоффа,
повышение темп-ры на каждые 100
увеличивает ск-ть реакции в 2-4 раза. |
|
31
Ск-ть гетерогенной хим.реакции.
Особенности ее протекания.Гетерогенные
(многофазные) реакции происходят на
поверх-ти раздела соприкасающихся
фаз. относятся: горение топлива,
окисление металлов кислородом,
растворение газа в жидкостях.Ск-ть
реакций зависит от размеров и состояния
поверхности раздела фаз. Гетерогенные
процессы многостадийны. Кроме осн-го
процесса,обязательны стадии подвода
к этой поверх-ти исходных веществ и
отвода от нее продуктов реакции.Если
определяющей стадией является
хим.реакция на поверхности раздела
фаз, то процесс описывается законами
хим.кинетики
Если, как это обычно бывает, наиболее
медленно совершается подвод и отвод,
то процесс описывается законами
диффузии
. Повышение темп-ры на каждые 100
увеличивает коэффициент диффузии на
20%, тогда как скорость реакции
увеличивается в 2-4 раза.Диффузия
оказывает большое влияние на протекание
гетерогенных процессов.1й
закон диффузии.Масса
веществ
Ур-е
стационарной диффузии:
|
32.Инициирование
химической реакции. Катализ. Сущность
гомогенного и гетерогенного катализа.
Инициирование-наиб.энергоемкая
стадия цепной реакции,ее эн.ативации
опрэнергией разрываемой хим.св..
Катализ-Изменение
скорости реакции под действием
некоторых веществ (катализаторов)
Различают положит.катализ и антикатализ.
При катализе ск-ть реакции увелич-ся,
при антикатализе - уменьшается.
Вещества, увеличивающие скорость
реакции-катализаторы,уменьшающ.-
ингибиторы.
Как правило катализатор при реакции
не расходуется, ингибитор
расходуется.Существует также и
автокатализ
- в роли катализатора вытсупают продукты
реакции.Пример: FeO+H2=Fe+H2O
Катализаторы
не
влияют
на |
33.Дисперсные системы. Коллоидные растворы.Д.с.Это система из двух и более в-в,которые практически не смешиваются и не реагируют друг с другом. Состоят из двух и более фаз(тел)с сильно развитой поверхностью раздела.в грубодисперсных системах частицы имеют размер от 10-4и выше,в коллоидных системах от 10-7 до 10-5-10-4. Дисп.сист.: эмульсии(масло в воде), сустензии(глина в воде),коллоидные растворы. Коллоидные растворы -высокодисперсные системы частицы интенсивно участвуют в броуновском движении,заполняя вечь объем дисперсной системы. Коллоидные частицы способны рассеивать свет. Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза. Диспе́ргатор РПГ- это аппарат, позволяющий диспергировать и получить коллоидный раствор двух и более практически несмешиваемых веществ. Обычно бывают рециркуляционного, встроенного и погружного типа. Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж. Суспензиоиды(лиофобные), ассоциативные(мицеллы) , молекулярные - коллоиды .
|
|
34.Растворы
(разбавленные, концентрированные,
насыщенные, перенасыщенные).
Растворимость. Способы выражения
концентрации растворов.Раствор
- гомогенная система, в которой одно
вещество равномерно распределено в
среде другого.
Р-р
- гомогенная система. В р-ре различают
растворитель
и растворяемое
вещество.Р-ры
газа в газе или жидкости в жидкости
называют смесями.
Разб.р-р–р-р,
в котором содержание одного из
компонентов меньше содержания другого
компонента.Конц.
р-р
– р-р, в котором отн-е кол-ва растворенного
вещ-ва и растворителя одного порядка.
Насыщ.р-р-растворенное
вещ-во при данных условиях более не
растворяется, даже при продолжительном
перемешивании. Концентрация
насыщ-го раст-ра - мера растворимости
вещ-ва при данных условиях. Раствор
пересыщенный,
если содержание растворенного вещ-ва
превышает предел насыщения данного
раствора.Пример.
При
|
35
Физические и химические процессы при
растворении. Растворимость твердых
тел и жидкостей в жидкостях.Р-рам
присущи признаки как химич.(однородность
раствора) соединения, так и механической
(изменение состава р-ра в широких
пределах, а также возможность обнаружения
в св-вах р-ра свойтсв отдельных слагающих
его компонентов) смеси. Физич.теория
растворов (Вант-Гофф).Растворитель
я-ся индифферентной средой, в которой
равномерно размешаны молекулы
растворенного в-ва по всему объему
р-ра. Взаимодействия между чатицами
и молекулами нет. Теория оправдывается
для разбавленных р-ров неэлектролитов.
Химич.теория
р-ров (Менделеев).Р-ль
дает с растворенным в-вом определенные
соединения – сольваты.Молекулы
сольватов образуют с растворителем
молекулярную смесь.Причина
образования сольватов – проявление
донорно-акцепторных и водородных
связей. Вокруг ионов располагаются
молекулы растворителя, образуя
сольватные
слои
(оболочки).Сольваты менее прочны, чем
обычные химические соединения. Легко
разрушаются даже при небольшом
повышении температуры растворов.Растворение
сопровождается выделением/поглощением
теплоты, сокращением/увеличением
объема.Теплота
растворения вещества
– кол-во теплоты, поглощаемой
(выделяемой) при растворении одного
моля вещества.Растворимость
твердых веществ в жидкостях.Зависит
от природы тв.тел, природы растворителя
и температуры.С повышением температуры,
как правило, растворимость увеличивается
(так как теплоты растворения имеют
отрицат. значения).Для идеальных р-ров
справедливо уравнение Шредера:
|
36.Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
З.Генри-Дальтона:При
некотором определенном давлении и
постоянной температуре растворяется
в жидкости определенное количество
газа, зависящее также и от свойств
жидкости. При увеличении или уменьшении
давления газовой атмосферы на жидкость
с сохранением той же температуры
увеличивается или уменьшается в таком
же отношении количество растворенного
газа.
Согласно
закону распределения, вещество,
растворенное в двух несмешивающихся
или ограниченно смешивающихся
жидкостях, распределяется между ними
в постоянном отношении. Это отношение
для идеальных систем зависит только
от температуры, природы вещества и не
зависит от концентрации. Из этого
закона следует, что при одновременном
растворении нескольких веществ каждое
из них распределяется между обеими
жидкими фазами таким образом, как
будто в системе нет никаких других
веществ, подлежащих распределению.
Закон распределения справедлив лишь
в том случае, если распределяемое
вещество в обеих фазах находится в
одной и той же форме. Константа
распределения вещества. Постоянная
величина, выражающая отношение
концентраций распределяемого вещества,
находящегося в обеих фазах (после
наступления равновесия) в одной и той
же форме, называется константой
распределения: где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/ |
|
|
38
Электролитическая диссоциация. Степень
диссоциации. Слабые электролиты.Электролиты
– вещества, которые в растворе или
расплаве состоят полностью или частично
из ионов.Они не подчиняются законам
Рауля: их растворы замерзают при более
низких температурах, а кипят при более
высоких температурах, чем растворы
неэлектролитов той же моляльной
концентрации.Электролитическая
диссоциация.Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясть в воде,
распадаются на ионы (заряженные
частицы). При этом каждый ион ведет
себя как самостоятельная частица.В
результате диссоциации концентрация
увеличивается (число частиц в единице
объема).»Академик Каблуков дополнил
теорию ЭД: «основная причина диссоциации
на ионы – взаимодействие с полярными
молекулами воды».Согласно закону
Кулона, сила притяжения между зарядами
|
39
Сильные электролиты. Понятие активности
и коэффициента активности.Электролиты
– вещества, которые в растворе или
расплаве состоят полностью или частично
из ионов.Они не подчиняются законам
Рауля: их растворы замерзают при более
низких температурах, а кипят при более
высоких температурах, чем растворы
неэлектролитов той же моляльной
концентрации.По способности диссоциации
электролиты делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы).Сильные
электролиты не только в разбавленных,
но и в концентрированных растворах
диссоциируют практически нацело.Степень
диссоциации примерно равна 1.Если
условно взять какой-либо ион за центр
и провести вокруг сферу произвольного
радиуса, можно заметить, что каждый
ион окружается как бы роем других
ионов – ионной
атмосферой.
Ионная
атмосфера препятсвует передвижению
ионов в растворе, что приводит к
уменьшению электропроводимости
раствора.Разбавление увеличивает
расстояния между ионами, уменьшает
из взаимодействие, что приводит к
увеличению электропроводности за
счет роста скорости ионов, а не за счет
роста степени диссоциации.Для растворов
сильных электролитов введено понятие
активности
(или активной концентрации). Активность
– величина, подстановка которой вместо
концентрации в термодинамические
уравнения, действительные для идеальных
систем, позволяет использовать их для
реальных систем.
|
|
40Электролитическая
диссоциация воды. Ионное произведение
воды. Водородный показатель. Понятие
об индикаторах.Электролиты
– вещ-ва, которые в растворе или
расплаве состоят полностью или частично
из ионов.Они не подчиняются законам
Рауля: их растворы замерзают при более
низких темп-рах, а кипят при более
высоких темп-рах. Электролитическая
диссоциация.Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясть в воде,
распадаются на ионы (заряженные
частицы). При этом каждый ион ведет
себя как самост.частица.В результате
диссоциации концентрация
увелич-ся).»Академик Каблуков дополнил
теорию ЭД: «основная причина диссоциации
на ионы – взаимодействие с полярными
молекулами воды».Согласно закону
Кулона, сила притяжения между зарядами
|
41 Гидролиз солей. Константа и степень гидролиза.Гидролиз - разложение солей под действием воды.Вторая формулировка. Процесс, обратный нейтрализации, приводящий к образованию кислоты и основания.Нейтрализация – реакция между кислотой и основанием.1. Гидролиза нет -если сильное основание и сильная кислота. -если нерастворимые вещества («н» в таблице).
Пример.
2. Полный гидролиз -если слабая кислота и слабое основание. -если «-» в таблице растворимости.
Пример.
3. -если сильное основание и слабая кислота. -если слабое основание и сильная кислота.
Пример.
Константа
гидролиза:
Степень гидролиза – применяется для характеристики реакций гидролиза.
Степень возрастает с ростом температуры и с уменьшением концентрации (разбавлением).
|
42 |
|
43
Окислительно-восстановительные
реакции. Ионно-электронный метод
подбора коэффициентов в
окислительно-восстановительных
реакциях.Любая
ОВР состоит из процессов окисления и
восстановления.Окисление
– отдача
электронов веществом, т.е повышение
степени окисления элемента.Пример.
Пример.
|
44
Возникновения скачка потенциала на
границе раздела «металл-расствор».
Равновесный электродный
потенциал.Электрохимия
– область
физической химии, охватывающая
химические процессы, сопровождающиеся
возникновением электрического тока,
либо вызванные действием электрического
тока.Электрод
– проводник 1 рода, погруженный в
раствор электролита в условиях
прохождения через него тока. В объеме
металла устанавливается подвижное
равновесие: Ме=Men++
n*ē.
При погружении электрода в воду катионы
металла гидратируются полярными
молекулами воды и переходят в раствор,
Men++
mH2O=Meрn+m*H2O.
Поверхность электрода заряжается
отрицательно за счет оставшихся
электронов, из-за этого перешедшие в
раствор катионы не могут отойти от
электрода. Катионы и электроны создают
двойной
электрический слой
(его толщина зависит от концентрации
раствора, температуры, заряда металла).
Пограничный слой жидкости заряжается
положительно, поверхность металла
отрицательно, возникает скачок
электрического потенциала – электродный
потенциал.Потенциал,
отвечающий состоянию равновесия,
когда скорость перехода ионов в раствор
равна скорости их осаждения –
равновесный
потенциал.Для
всех металлов, погружаемых в чистую
воду, качественно наблюдается одинаковая
картина: металл заряжается отрицательно,
прилегающий слой жидкости –
положительно.Данный скачок можно
охарактеризовать реакцией:
|
45
Медно-цинковый гальванический элемент
Якоби-Даниэля. Процессы на электродах.
Понятие ЭДС.Гальванический элемент
– любое устройство, дающее возможность
получать электрический ток за счет
проведения той или иной химической
реакции.Рассмотрим систему, в которой
медь и цинк в виде пластинок помещены
в растворы своих солей, разделенных
перегородкой – диафрагмой.
При разомкнутой цепи электроды
приобретают равновесные потенциалы,
которые отличаются по знаку и по
величине. При ее замыкании электроны
от цинкового электрода перемещаются
к медному. На электродах нарушается
равновесие:
|
|
46
Зависимость ЭДС гальванического
элемента от природы реагирующих
веществ, температуры и концентрации.
Стандартная ЭДС.Гальванический элемент
– любое устройство, дающее возможность
получать электрический ток за счет
проведения той или иной химической
реакции.Влияние
природы реагирующих веществ.Пусть
протекает реакция:
|
47
Стандартный водородный электрод.
Формула Нернста. Стандартный потенциал.
Ряд напряжений.В
настоящее время невозможно рассчитать
или экспериментально определить
абсолютное значение потенциала на
отдельно взятом электроде (абсолютный
электродный потенциал).Поэтому
значение потенциала на электроде
всегда определяется по отношению к
эталонному электроду, потенциал
которого условно принимается за нуль.В
электрохимии таким электродом является
нормальный
водородный элемент.Его
устройство: в стеклянный сосуд сложной
формы залит раствор серной кислоты
такой концентрации, что
|
|
|
49
Электролиз. Последовательность разряда
ионов на катоде и аноде. Электролиз
- это окислительно-восстановительный
процесс, протекающий при прохождении
постоянного тока через раствор или
расплав электролита.Сущность
электролиза:
на катоде(-) идет процесс восстановления,
на аноде(+) – процесс окисления.Пример.
|
50
Законы Фарадея. Выход по току.Первый
закон:
при электролизе данного электролита
количества веществ, выделяющихся на
электродах, прямо пропорционально
количеству электричества, прошедшему
через электролит. |
51 |
|
|
53 Основные методы борьбы с коррозией.Коррозия – самопроизвольно протекающий процесс поверхностного окисления металла в результате его химического или электрохимического взаимодействия с окружающей средой.В результате коррозии металл из свободного состояния переходит в связанное. Потери от коррозии велики: десятки миллиардов долларов в индустриально-развитых странах.Методы борьбы различны: -антикоррозийное легирование металла
– введение
в металл добавок, чтобы повысить
стойкость основного металла.защитные
покрытия
(металлические и неметаллические).металлические
наносятся под давлением сжатого
воздуха. характерно покрытие листового
материала тонким слоем другого
материала.неметаллические – лаки
,краски, битум, солидол.-ингибиторы
коррозии.вещества,
замедляющие процесс разрушения
металла.Пример.
|
54.Кристаллическое состояние вещества. Химическая связь в кристаллах.Твердые вещества могут находиться в аморфном или кристаллическом состояниях.Вещества в аморфном состоянии не имеют четкой структуры, их иногда называют «переохлажденными жидкостями с аномально высокой вязкостью».Кристаллические структуры.Наименьшая структурная единица – элементарная ячейка. В зависимости от решеток и углов между характеристическими осями различают 7 основных видов (кубическая, ромбоэдрическая и пр.).Тип кристаллической системы определяется природой и размерами частиц, видом химических связей между ними, температурой и другими факторами.Многие соединения могут существовать в двух и более кристаллических структурах. Это явление – полиморфизм.Все кристаллы можно разделить по видам химической связи. Стоит отметить, что существуют кристаллы со смешанными связями.1. Молекулярная связь.В узлах кристаллических решеток находятся молекулы, между которыми дейтсвуют вандерваальсовы силы, имеющие невысокую энергию.Для кристаллов с молекулярными связями характерны низкие температуры плавления и высокая сжимаемость.2. Ковалентная связь.В узлах кристаллов располагаются атомы, образующие прочные ковалентные связи.Это обуславливает высокую энергию решетки.Кристаллы с ковалентной связью - диэлектрики или полупроводники. Типичными примеры: алмаз и кремний.3. Ионная связь.Структурные единицы – положительно и отрицательно заряженные ионы, между которыми происходит электростатическое взаимодействие, характеризуемое высокой энергией.Кристаллы с ионной связью при низких температурах являются диэлектриками. При температурах близких к температуре плавления они становятся проводниками электричества.4. Металлическая связь.Специфические свойства металлов (высокая проводимость, теплопроводность, ковкость, пластичность, металлический блеск) можно объяснить особым типом связи – металлическая.Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны удерживают вместе положительные ионы, в противном случае решётка распалась бы под действием сил отталкивания между ионами. 5. Смешанная связь.Тот или иной вид связи встречается редко, обычно – наложение двух или более связей. |
|
55. Составные части системы и компоненты. Правило фаз. Правило фаз записывается следующим образом:
где j — число фаз (например, агрегатных состояний вещества); v — число степеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз; k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы. n — число переменных, характеризующих влияние внешних условий на равновесие системы. При переменных давлении и температуре правило фаз сводится к выражению:
В случае однокомпонентной системы оно упрощается до:
Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия. Иногда правило фаз записывают следующим образом:
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2.
|
5
|
|
|
58
Поверхностные явления. Понятие
поверхностного натяжения.Поверхностное
натяжение
– избыток свободной энергии в
поверхностном слое, отнесенный к
Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз. Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами. Поверхностные явления изучаются коллоидной химией.
|
59 |
60 |

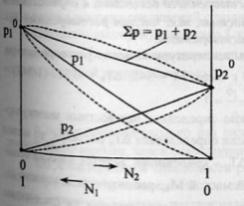 37
Законы Рауля.Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем. Первый
закон.Давление
пара растворителя над раствором
пропорционально мольной доле
растворителя в растворе.или Относительно
понижение давление пара растворителя
над раствором равно мольной доли
растворенного вещества.Введем
обозначения:
37
Законы Рауля.Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем. Первый
закон.Давление
пара растворителя над раствором
пропорционально мольной доле
растворителя в растворе.или Относительно
понижение давление пара растворителя
над раствором равно мольной доли
растворенного вещества.Введем
обозначения: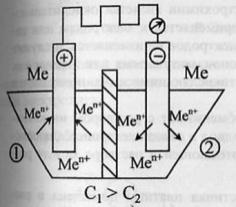
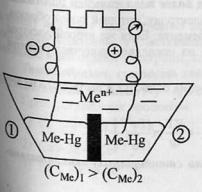 48
Типы электродов. Окислительно-восстановительный
электроды.Электрод
– проводник 1 рода, погруженный в
раствор электролита в условиях
прохождения через него тока. Три
типа:
электроды первого, второго и третьего
рода.Электроды
1-го рода.Металлы,
погруженные в растворы своих солей.солей:
48
Типы электродов. Окислительно-восстановительный
электроды.Электрод
– проводник 1 рода, погруженный в
раствор электролита в условиях
прохождения через него тока. Три
типа:
электроды первого, второго и третьего
рода.Электроды
1-го рода.Металлы,
погруженные в растворы своих солей.солей:
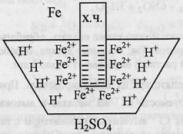
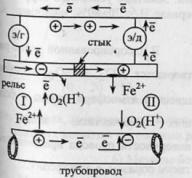 52.Коррозия
металлов. Химическая и электрохимическая
коррозия.Коррозия – самопроизвольно
протекающий процесс поверхностного
окисления металла в результате его
химического или электрохимического
взаимодействия с окружающей средой.В
результате коррозии металл из свободного
состояния переходит в связанное.
Потери от коррозии велики: десятки
миллиардов долларов в индустриально-развитых
странах.Химическая
коррозия (газовая и жидкостная).Газовая
– разрушение происходит в атмосфере
сухого газа – окислителя (кислород,
галогены).
52.Коррозия
металлов. Химическая и электрохимическая
коррозия.Коррозия – самопроизвольно
протекающий процесс поверхностного
окисления металла в результате его
химического или электрохимического
взаимодействия с окружающей средой.В
результате коррозии металл из свободного
состояния переходит в связанное.
Потери от коррозии велики: десятки
миллиардов долларов в индустриально-развитых
странах.Химическая
коррозия (газовая и жидкостная).Газовая
– разрушение происходит в атмосфере
сухого газа – окислителя (кислород,
галогены).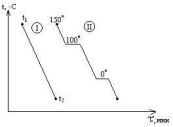
 6
Сущность термографического анализа.
Кривые нагревания и охлаждения.Термографический
анализ
– кривые нагревания или кривые
охлаждения системы. Диаграммы плавкости
(частный вид диагарамм состояния)
строят исходя из кривых охлаждения,
которые изображаются в координатах:
температура(Оу), время(Ох). Рассмотрим
кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых
превращений, температура меняется
монотонно. Кривая II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу –
процессу конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство
температуры обеспечивается за счёт
выделения в процессе конденсации пара
теплоты испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода.
При 0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.Рассмотрим
кривые
охлаждения
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления.Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения
сплава замедляется, и на кривой
наблюдается перелом. Выпадение
кристаллов А продолжается до тех пор,
пока жидкая фаза не достигнет так
называемого “эвтектического состава”.
Основной особенностью эвтектического
сплава является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при
tЕ
(отрезок bc)
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Отрезок
cd
отвечают охлаждению твердого
сплава.Остановки в падении температуры
могут наблюдаться и на кривой охлаждения
уже твердого металла, указываю на
переходы металла из одной аллотропной
формы в другую.
6
Сущность термографического анализа.
Кривые нагревания и охлаждения.Термографический
анализ
– кривые нагревания или кривые
охлаждения системы. Диаграммы плавкости
(частный вид диагарамм состояния)
строят исходя из кривых охлаждения,
которые изображаются в координатах:
температура(Оу), время(Ох). Рассмотрим
кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых
превращений, температура меняется
монотонно. Кривая II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу –
процессу конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство
температуры обеспечивается за счёт
выделения в процессе конденсации пара
теплоты испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода.
При 0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.Рассмотрим
кривые
охлаждения
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления.Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения
сплава замедляется, и на кривой
наблюдается перелом. Выпадение
кристаллов А продолжается до тех пор,
пока жидкая фаза не достигнет так
называемого “эвтектического состава”.
Основной особенностью эвтектического
сплава является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при
tЕ
(отрезок bc)
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Отрезок
cd
отвечают охлаждению твердого
сплава.Остановки в падении температуры
могут наблюдаться и на кривой охлаждения
уже твердого металла, указываю на
переходы металла из одной аллотропной
формы в другую.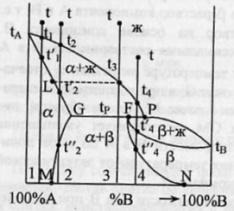
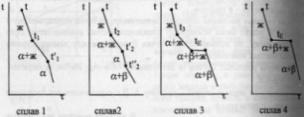
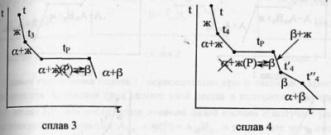 57
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав. Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная
взаимная растворимость компонентов
в жидком состоянии и ограниченная - в
твердом. Если твердые растворы образуют
эвтектику,
то точка нонвариантного равновесия
Е лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия
FN-снижение
растворимости А в В при понижении t
от tЕ
до
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения
сплава
1
имееются 2 перегиба,отвечающих началу
и концу выделения кристаллов тв.р-ра
α.На кривой охлаждения сплава
2
дополнительно наблюдается слабо
выраженный перегиб при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3:
при t3
из жид.фазы выделяются кристаллы
тв.р-ра α,жид.фаза при понижении от t3
до
tЕ
меняет свой состав по линии
t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси
2 тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается
площадка.Сплав
4
точно отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
чистого компонента. Система А-В с
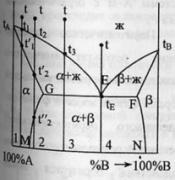
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α
и β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4
при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с
выделением кристаллов тв.р-ра α.
57
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав. Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная
взаимная растворимость компонентов
в жидком состоянии и ограниченная - в
твердом. Если твердые растворы образуют
эвтектику,
то точка нонвариантного равновесия
Е лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия
FN-снижение
растворимости А в В при понижении t
от tЕ
до
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения
сплава
1
имееются 2 перегиба,отвечающих началу
и концу выделения кристаллов тв.р-ра
α.На кривой охлаждения сплава
2
дополнительно наблюдается слабо
выраженный перегиб при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3:
при t3
из жид.фазы выделяются кристаллы
тв.р-ра α,жид.фаза при понижении от t3
до
tЕ
меняет свой состав по линии
t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси
2 тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается
площадка.Сплав
4
точно отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
чистого компонента. Система А-В с
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α
и β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4
при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с
выделением кристаллов тв.р-ра α.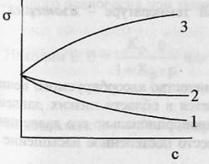 1
и 2 – поверхностно-активные вещества
(ПАВ).3 – поверхностно-инактивные
вещества (ПИАВ).Разность
C
в поверхностном слое – поверхностный
избыток вещества Г (гамма).Для
ПАВ Г>0, для ПИАВ Г<0.Поверхность
твердых тел, как и жидкостей, обладает
избыточной свободной
энергией Гиббса.
Твердые тела не могут (в отличие от
жидкостей) самопроизвольно изменять
площадь поверхности.
1
и 2 – поверхностно-активные вещества
(ПАВ).3 – поверхностно-инактивные
вещества (ПИАВ).Разность
C
в поверхностном слое – поверхностный
избыток вещества Г (гамма).Для
ПАВ Г>0, для ПИАВ Г<0.Поверхность
твердых тел, как и жидкостей, обладает
избыточной свободной
энергией Гиббса.
Твердые тела не могут (в отличие от
жидкостей) самопроизвольно изменять
площадь поверхности.