
8.2. Постулаты н. Бора
Н. Бор дополнил планетарную модель Резерфорда путем введения предположений (постулатов), основанных как на экспериментальных фактах, например, линейчатый спектр испускания атома водорода или дискретность энергетических уровней электронов в атоме, открытых Д. Франком и Г. Герцем, так и учитывающих некоторые положения атомных моделей Томпсона и Резерфорда. Важно отметить, что эти предположения противоречат как законам классической механики, так и законам классической электродинамики.
Первый постулат:
"Из бесконечного множества электронных орбит, возможных с позиций классической механики, реализуются лишь те, на которых момент импульса электрона равен постоянной Планка, деленной на 2. Электрон, находящийся на такой орбите, двигается с ускорением, но не излучает электромагнитных волн (света). Такое состояние электрона и, соответственно, орбита, называются стационарными".
М атематически
это записывается "Механика …".Лекция
5.
атематически
это записывается "Механика …".Лекция
5.
![]() или
или
![]() ,
,
![]()
где
![]() ,
,
![]() - масса и
скорость электрона,
- масса и
скорость электрона,
![]() ,
,
![]()
![]() - радиус орбиты,
- радиус орбиты,
![]() - число,
называе -
- число,
называе -
![]()
мое
главным квантовым числом, при -
![]()
чем
= 1,
2, 3, 4, . . . .
![]()
![]()
![]()
Второй постулат.
"Излучение испускается и поглощается в виде светового кванта энергии при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона".

![]() .
.
![]()
Здесь
![]() - энергия
электрона, соответственно, на
- энергия
электрона, соответственно, на
![]() и
- орбитах,
,
- целые
числа (номера орбит).
и
- орбитах,
,
- целые
числа (номера орбит).
Первый постулат называют иногда постулатом стационарных состояний, а второй - правилом частот.
8.3. Боровская теория атома водорода
 Дано:
электрон движется по круговой орбите
радиуса
в поле атомного
ядра с зарядом
.
(При
Дано:
электрон движется по круговой орбите
радиуса
в поле атомного
ядра с зарядом
.
(При
![]() модель
соответствует атому водорода, при
других
- водородо-
модель
соответствует атому водорода, при
других
- водородо-
подобному иону).
Найти: радиус орбиты, ско -
рость движения и энергию электро -
на.
Как отмечено разделе 8.1 стационарная орбита для электрона в атоме будет устойчивой, если в принятых на рисунке обозначениях

![]()
![]()
Величина
![]() при расчетах не учи -
при расчетах не учи -
![]()
тывается,
т. к. является константой.
![]()
После
преобразования
![]() .
Используем первый постулат:
.
Используем первый постулат:
![]() и из
и из
![]()

![]()
![]()
Отсюда
![]() или
или
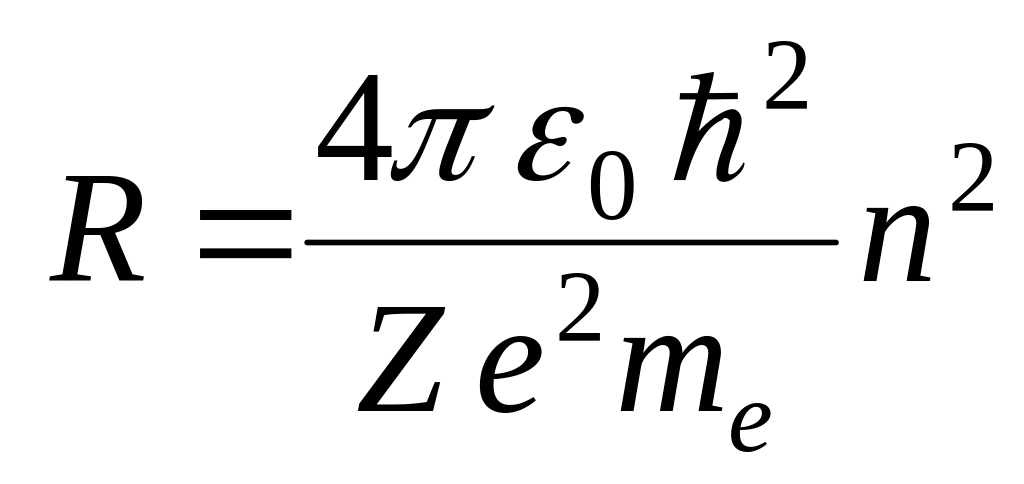 .
.
Анализ:
1)
Для первой орбиты водородного атома
(![]() )
после
расчета
)
после
расчета
![]()
т. е. величина порядка газокинетических размеров атома водорода.
2) Радиусы орбит электрона дискретны, т. к. n - целое число.
3) Радиусы допустимых орбит атома водорода относятся как квадраты порядковых номеров орбит:
R1 : R2 : R3 : R4 : . . . = 1 : 4 : 9 : 16 : . . .
4 )
Из
следует
)
Из
следует
![]() или
или
![]()
![]() ,
т. е. скорости электрона на разных
орбитах разные и обратно пропорциональны
номеру орбиты.
,
т. е. скорости электрона на разных
орбитах разные и обратно пропорциональны
номеру орбиты.
5)
Из соотношения
![]()
![]() .
.
![]()
 Вычислим
внутреннюю энергию атома
Вычислим
внутреннюю энергию атома
![]() ,
где
,
где
![]() -
потенциальная энергия взаимодействия
электрона с ядром. Величина
была определена нами ранее
-
потенциальная энергия взаимодействия
электрона с ядром. Величина
была определена нами ранее
![]()
(см.
"Основы электродинамики". Лекция
1.),
![]()
тогда
![]()
![]() .
.
![]()
Анализ:
1)
Кинетическая энергия электрона на любой
![]()
орбите
составляет половину от потенциальной.
![]()
![]() ,
,
![]() .
.
2) Полная энергия атома отрицательна и равна
![]() .
.
3)
![]() и при
возрастании
,
величина
и при
возрастании
,
величина
![]() - увеличивается.
- увеличивается.
4)
Энергия атома дискретна т. к. зависит
от
,
где
![]()
5) Схема энергетических уровней атома водорода может быть представлена в виде (см. рисунок).
6)
При переходе атома водорода 
( ) из состояния в состоя-
ние испускается квант света
![]()
тогда частота излучения
![]()
т. е. получается обобщенная
формула
Бальмера, причем постоянная Ридберга
![]() .
.
7) Спектр испускания атома водорода можно схематически изобразить в виде переходов электрона с одного энергетического уровня на другой, т. е.
серия Лаймана ( = 94 - 122 нм).
Переходы 2 - 7 . . . 1;
серия Бальмера ( = 397 - 656 нм).
Переходы 3 – 7 . . . 2;
серия Пашена ( = 1000 - 1900 нм).
Переходы 4 – 7 . . . 3;
серия Брекета ( = 2100 - 4000 нм).
Переходы 5 – 7 . . . 4;
серия Пфунда ( = 4650 - 7500 нм).
Переходы 6 – 7 . . . 5.
8)
Из
![]() следует, что максимальное значение
частоты (
следует, что максимальное значение
частоты (![]() )
получается
при
)
получается
при
![]() = 1. В этом
случае
= 1. В этом
случае
![]() .
Это максимальная энергия, которую может
излучать атом водорода. Полученное
значение
.
Это максимальная энергия, которую может
излучать атом водорода. Полученное
значение
![]() называется энергией ионизации.
называется энергией ионизации.
Теория Бора сыграла огромную роль в создании атомной физики. С ее помощью были объяснены физическая природа характеристических рентгеновских спектров, расщепление спектральных линий в сильном магнитном поле (эффект Зеемана), молекулярные спектры и другие явления. Однако, наряду с определенными успехами, в теории Бора обнаруживаются существенные недостатки:
а) Состояние электрона в водородоподобной системе не может быть описано одним квантовым числом.
б) Внутренняя противоречивость – теория основывается на механическом соединении положений классической физики с квантовыми постулатами.
в) Ограниченность, т. е. ее невозможно применить к созданию теории других атомов, например, гелия – второго элемента периодической системы.
Очевидно, что теория Бора, объясняющая одни экспериментальные данные и не способная истолковать другие, представляет собой лишь переходной этап на пути создания последовательной теории атомных и ядерных явлений. Такой теорией явилась квантовая (волновая) механика, которая позволила не только объяснить многообразие явлений атомной и ядерной физики, но и вскрыть физическое содержание самих постулатов Бора.
