
- •Введение
- •1. Строение и свойства материалов
- •1.1. Классификация материалов
- •1.2. Кристаллическое строение материалов
- •1.3. Кристаллизация металлов
- •1.4. Деформация и разрушение металлов
- •1.5. Свойства материалов и методы их испытаний
- •2. Основы теории двойных сплавов
- •2.1. Строение сплавов
- •2.2. Диаграммы состояния двойных сплавов
- •2.3. Диаграмма состояния железоуглеродистых сплавов
- •2.4. Углеродистые стали
- •2.5. Чугуны
- •3. Основы термической обработки сталей
- •3.1. Механизмы основных превращений
- •5. Особенности мартенситного превращения.
- •3.2. Отжиг стали
- •3.3. Закалка и отпуск
- •4. Поверхностное упрочнение деталей
- •4.1. Упрочнение методом пластической деформации
- •4.2. Упрочнение методом поверхностной закалки
- •4.3. Химико-термическая обработка
- •5. Легированные стали
- •5.1. Маркировка легированных сталей
- •5.2. Классификация легированных сталей
- •6. Цветные металлы и сплавы
- •6.1. Титан и его сплавы
- •6.2 Алюминий и его сплавы
- •6.3. Магний и его сплавы
- •6.4. Медь и ее сплавы
- •6.5. Другие цветные металлы и сплавы
- •7. Неметаллические и композиционные материалы
- •7.1. Полимеры
- •7.2. Пластмассы
- •7.3. Композиционные материалы
- •7.3. Керамические материалы
- •8. Металлургическое производство
- •8.1. Основные сведения о производстве чугуна
- •8.2. Производство стали
- •8.3. Разливка стали
- •9. Литейное производство
- •9.1. Литейные свойства сплавов
- •9.2. Литье в песчано-глинистые формы
- •9.3. Плавильные печи
- •9.4. Специальные способы литья
- •9.5. Сплавы для изготовления отливок
- •10. Обработка металлов давлением
- •10.1. Прокатка
- •10.2. Волочение и прессование
- •10.3. Ковка
- •10.4. Штамповка
- •11. Обработка металлов резанием
- •11.1. Основы резания металлов
- •11.2. Обработка на токарных станках
- •11.3. Обработка на сверлильных станках
- •11.4. Обработка на фрезерных станках
- •11.5. Обработка на строгальных и долбежных станках
- •11.6. Обработка на шлифовальных и отделочных станках
- •11.7. Точность и качество поверхности при обработке
- •12. Сварка, резка и пайка
- •12.1. Сварка металлов плавлением
- •12.2. Сварка металлов давлением
- •12.3. Термическая резка и пайка металлов
- •Области применения способов термической резки
- •13. Электрофизические и электрохимические способы обработки материалов
- •13.1. Электрофизические способы
- •13.2. Электрохимические способы
- •14. Основы рационального выбора материалов
- •14.1. Выбор материала
- •14.2. Основные направления экономии материалов
- •Литература
- •Оглавление
- •Евгений Петрович Чинков
- •Андрей Геннадьевич Багинский
- •Материаловедение и технология
- •Конструкционных материалов
- •Подписано к печати.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
высшего профессионального образования
«Томский политехнический университет»
Е. П. Чинков, А. Г. Багинский
МАТЕРИАЛОВЕДЕНИЕ И ТЕХНОЛОГИЯ
КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
Учебное пособие
Второе издание, исправленное и дополненное
Издательство ТПУ
Томск 2009
УДК 620.22
Чинков Е. П., Багинский А. Г.
Материаловедение и технология конструкционных материалов:
Учебное пособие. – 2-е изд., испр. и доп. –Томск: Изд-во ТПУ,
2009. –180 с.
В учебном пособии в краткой форме изложены закономерности формирования структуры и свойств металлических и неметаллических материалов, используемых в машиностроении. Большое внимание уделено фундаментальным основам теории и технологии термической обработки металлических материалов. Изложены основы технологии литейного производства, обработки давлением, сварки, механической обработки.
Учебное пособие соответствует программе дисциплины и предназначено для студентов немашиностроительных специальностей.
Пособие написано на основе лекций, прочитанных авторами на кафедре «Материаловедения и технологии металлов» ТПУ студентам дневной формы обучения.
УДК 620.22
Рекомендовано к печати Редакционно-издательским советом
Томского политехнического университета
Рецензенты:
Б. П. Гриценко – доктор технических наук, профессор
старший научный сотрудник Института физики
прочности и материаловедения СО РАН;
Н. В. Коробейников – главный инженер ООО «Томский
инструментальный завод».
© Томский политехнический университет, 2009
Введение
Получение, разработка новых материалов и способы их обработки являются основой современного производства, уровень развития которого определяет научно-технический и экономический потенциал страны. Проектирование конкурентно-способных изделий, организация их производства невозможны без достаточного уровня знаний в области материаловедения и технологии конструкционных материалов.
Материаловедение – наука о строении и свойствах металлических и неметаллических материалов, их взаимосвязи и возможности изменения для рационального использования в технике.
Разнообразие свойств материалов является главным фактором, предопределяющим их широкое применение в технике. В современной технике имеется огромное количество различных устройств, машин и механизмов, строительных конструкций, приборов, оборудования и инструментов, которые работают в жестких условиях износа, а также воздействия высоких нагрузок, агрессивных сред, высоких и низких температур. Для того чтобы обеспечить их работоспособность, надежность и долговечность, инженер должен иметь представление о возможности формирования необходимых свойств современных материалов, уметь ориентироваться во множестве вариантов и владеть основами знаний, необходимых при выборе материала для конкретных деталей и изделий. Кроме того, инженер должен знать возможности прогнозирования необходимых свойств используемых материалов и изготавливаемых из них деталей и изделий.
Технология конструкционных материалов – совокупность знаний о современных методах обработки конструкционных материалов, об оборудовании, применяемом для получения деталей машин с необходимой точностью и качеством, и о рациональном их использовании.
При конструировании машин и оборудования инженер должен иметь представление о взаимосвязи конструкции изделия с технологией ее изготовления. Знать технологические методы получения и обработки заготовок и деталей машин, области их рационального применения, представлять технологические возможности типового оборудования используемого на своем предприятии. Уметь правильно выбрать метод изготовления заготовок и деталей машин в соответствии с требованиями к точности и качеству, и обязательно с учетом условий последующей эксплуатации готового изделия. Уметь выполнить сравнительный анализ различных вариантов технологического процесса.
1. Строение и свойства материалов
1.1. Классификация материалов
Материал – вещество (совокупность веществ), из которого изготовлено техническое изделие, имеющее функциональное значение.
Конструкционные материалы – материалы, из которых изготовляются детали машин, конструкций, работающих под нагрузкой. Эти материалы классифицируются: по природе – на металлические, неметаллические и композиционные и др.; по технологическому признаку – на деформируемые, литые, спекаемые, свариваемые и др.; по условиям работы – на работающие при низких температурах, жаропрочные, коррозионностойкие, износостойкие и др.; по прочности – на материалы малой, средней и высокой прочности.
Металлические материалы классифицируются: по системам сплавов – на алюминиевые, медные, никелевые сплавы, сплавы на железной основе и др.; по типу упрочнения – на закаливаемые, цементуемые, азотируемые и др.; по структурному составу – на однофазные, двухфазные, многофазные. Черные металлы – железо и сплавы (стали, чугуны) с содержанием железа не менее 50 %. Цветные – металлы и их сплавы, имеющие естественную окраску (медь, алюминий, титан и др.). Благородные – золото, серебро, платина и др. Редкоземельные – лантан, неодим, празеодим и др.
Неметаллические материалы подразделяют по изомерному составу и технологическому исполнению (прессованные, тканые, намотанные, формованные и др.), по типам наполнителей (армирующих элементов) и характеру их размещения и ориентации. Пластмассы – материалы на основе высокомолекулярных соединений – полимеров, чаще всего с добавками. Керамические материалы (керамики) – порошки тугоплавких соединений: карбиды, окислы, нитриды, бориды. Керамико-металлические – керамики с добавлением металлической связки. Стекла – окислы различных элементов. Резина – материал на основе каучука – углеродно-водородного полимера с добавлением серы и других элементов. Древесина – органическая ткань древесных растений.
Композиционные материалы состоят из металлической или неметаллической матрицы (основы) с заданным распределением в ней упрочнителей (волокон, дисперсных частиц и др.). Подразделяются на: дисперсноупрочненные, полученные введением в металлическую матрицу дисперсных частиц упрочнителей; волокнистые, упрочненные непрерывными волокнами и нитевидными кристаллами; слоистые, созданные путем прессования, прокатки разнородных материалов.
Рождение материала происходит в направлении усложнения структуры (рис. 1.1) и отражает определенные уровни его строения. Вещества состоят из атомов и молекул. Атом состоит из ядра и электронов. Силы, связывающие электроны и атомные ядра в атомах, атомы в молекулах, имеют электромагнитную природу.
Движущими силами объединения частиц вещества (твердого, жидкого, газообразного) являются силы взаимного притяжения и отталкивания. Процесс рождения материала осуществляется в направлении
плазма газ жидкость твердое тело
(атом молекула вещество)
на каждом этапе сопровождается уменьшением энергии системы, и поэтому развивается самопроизвольно. Наибольшим запасом энергии вещество обладает в состоянии плазмы. При разрушении (диспергировании) вещества процесс идет в обратном направлении и сопровождается поглощением энергии.
Л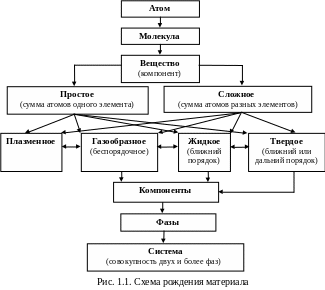 юбой
материал есть сложная физико-химическая
система. В металловедении системами
являются металлы и металлические сплавы.
юбой
материал есть сложная физико-химическая
система. В металловедении системами
являются металлы и металлические сплавы.
Система – группа тел, выделяемых для наблюдения и изучения. Компоненты – минимальное число химически различимых веществ, образующих систему (чистые вещества и химические соединения).
Фаза – совокупность однородных частей системы, отделенных от других частей поверхностью раздела, при переходе через которую свойства, структура и химический состав резко изменяются.
Твердое тело является одним из агрегатных состояний вещества. Оно отличается от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы. Твердые тела могут быть аморфными и кристаллическими. Аморфное твердое тело можно рассматривать как жидкость с очень большой вязкостью. У кристаллических тел, в отличие от аморфных, присутствует дальний порядок в расположении атомов.
Классификация твердых тел по типу связи.
Химическая связь образуется за счет электростатического взаимодействия между заряженными частицами: катионами и анионами, ядрами и электронами. Энергия химической связи неодинакова для разных твердых тел. Химические связи в кристаллах подразделяются на ковалентные, ионные, металлические и молекулярные. Ионная связь возникает в результате полного или частичного обмена валентными электронами, ковалентная – при частичном обмене. Металлическая связь по природе ковалентная, но обобществляется множество электронов. Силы Ван-дер-Ваальса возникают без обмена зарядами.
Ковалентная (гомеополярная) связь возникает между нейтральными соседними атомами за счет перекрытия их электронных облаков. Обычно она осуществляется двумя электронами с противоположно направленными спинами. В пространстве между ядрами атомов электроны создают состояния с повышенной электронной плотностью. Образовавшийся отрицательный заряд между ядрами стремится приблизить их. Если электронная плотность расположена симметрично между атомами, то ковалентная связь называется неполярной. Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной. Одно из существенных свойств ковалентной связи – насыщаемость. При ограниченном числе внешних электронов между ядрами образуется ограниченное число электронных пар вблизи каждого атома (ограниченное число химических связей). Другое важное свойство ковалентной связи – направленность в пространстве. Это проявляется в примерно одинаковом геометрическом строении близких по составу химических частиц. Особенность ковалентной связи – поляризуемость. Энергия ковалентной связи – сотни килоджоулей на моль. Ковалентные кристаллы – в основном полупроводники и диэлектрики.
Ионная связь образуется за счет кулоновского (электростатического) взаимодействия противоположно заряженных ионов. Такую связь называют ионной или гетерополярной. Взаимодействие между катионами и анионами не зависит от направления. Об ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. В ионных кристаллах не существует отдельных молекул. «Молекулой» ионного соединения следует считать весь кристалл. Например, в кристалле поваренной соли NaCl каждый положительно (отрицательно) заряженный ион натрия (хлора) окружен соответствующим числом отрицательно (положительно) заряженных ионов хлора (натрия). Ионная связь – сильная связь с энергией от сотен до десятков тысяч килоджоулей на моль. Поэтому твердые тела с ионной связью имеют высокие температуры плавления. Ионные кристаллы – в основном диэлектрики, прозрачны в широком диапазоне частот.
Идеальной ионной связи практически не существует. Даже в тех соединениях, которые относят к ионным, не происходит полного перехода электронов от одного атома к другому и электроны частично остаются в общем пользовании. Так, связь в кристалле фторида лития LiF на 80 % ионная, на 20 % – ковалентная. Поэтому правильнее говорить о степени ионности (полярности) ковалентной химической связи.
Металлическая связь. Атомы металлов отличаются от атомов других элементов тем, что слабо удерживают свои внешние электроны. В кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. Связь возникает вследствие взаимодействия положительных ионов решетки с электронным газом: электроны, находящиеся между ионами стремятся приблизить их друг к другу, уравновешивая силы отталкивания. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Энергия металлической связи сравнима с энергией ковалентной связи. Благодаря наличию свободных, не связанных с определенными атомами электронов, металлы хорошо проводят электрический ток и тепло. При нагревании металла колебания катионов усиливаются. Электронам труднее продвигаться между ними, поэтому электрическое сопротивление металла увеличивается.
Металлическая связь существует не только в твердых кристаллах металлов, но и расплавах и аморфном состоянии. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи. В кристаллах металлов атомы ионизированы не полностью, часть валентных электронов остается связанной. В результате возможно появление ковалентных связей между соседними атомами. Вклады ионной и ковалентной составляющей обнаружены во многих металлах.
Молекулярная связь. Взаимодействие молекул между собой не приводит к разрыву или образованию новых химических связей. В их основе также лежат электрические взаимодействия. В узлах кристаллической решетки находятся определенным образом ориентированные нейтральные молекулы. Они связаны слабыми ван-дер-ваальсовыми силами, которые включают все виды межмолекулярного притяжения и отталкивания. Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают (HCl, H2O, NH3), ориентируются так, чтобы рядом находились концы с противоположными зарядами. Между ними возникает ориентационное взаимодействие – притяжение. Индукционное взаимодействие возникает между полярными и неполярными молекулами. Неполярная молекула становится полярной (поляризуется), молекулы начинают притягиваться друг к другу, только слабее, чем в случае полярных молекул. Дисперсионное взаимодействие возникает между неполярными молекулами. Находясь в постоянном движении, электроны создают состояния с повышенной электронной плотностью с одной стороны молекулы, т. е. неполярная молекула станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, между ними устанавливаются кратковременные связи. Если бы молекулы только притягивались друг к другу, то это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться – межмолекулярное отталкивание.
Типичные кристаллы с молекулярной связью – O2, N2, CO2, H2O в твердом состоянии (при низких температурах). В электрическом отношении молекулярные кристаллы являются диэлектриками.
В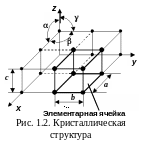 реальных кристаллах рассмотренные выше
связи в чистом виде встречаются редко.
Практически всегда имеет место наложение
связей. Одна из них имеет превалирующее
значение, определяя структуру и свойства
твердого тела.
реальных кристаллах рассмотренные выше
связи в чистом виде встречаются редко.
Практически всегда имеет место наложение
связей. Одна из них имеет превалирующее
значение, определяя структуру и свойства
твердого тела.
