- •1 Охрана труда при выполнении лабораторных работ в лаборатории № 324 3
- •2 Лабораторные работы по курсу «Водоподготовка и водно-химические режимы тэс и аэс». Часть 1. Водоподготовка 12
- •1 Охрана труда при выполнении лабораторных работ в лаборатории № 324
- •1.1 Общие требования
- •1.2 Характеристика основных химических веществ, применяемых в лаборатории № 324
- •1.2.1 Аммиак водный технический nh4oh.
- •1.2.2 Едкий натр NaOh.
- •1.2.3 Серная кислота h2so4.
- •1.2.4 Соляная кислота.
- •1.2.5 Полиакриламид паа.
- •1.2.6 Трилон б.
- •1.2.7 Гидразингидрат n2h4h2o.
- •1.3 Хранение кислот и щелочей.
- •1.4 Требования по охране труда в аварийных ситуациях
- •1.5 Необходимые реагенты и их приготовление
- •1.5.1 Приготовление растворов кислот и щелочей
- •1.5.2 Приготовление раствора трилона б
- •1.5.3 Приготовление аммиачного буферного раствора
- •1.5.4 Приготовление раствора натрия сернистого
- •1.5.5 Расчет и приготовление рабочего раствора коагулянта оксихлорида алюминия(оха)
- •1.5.6 Приготовление растворов индикаторов
- •Выполнение определения.
- •Лабораторная работа № 2 Определение сухого и плотного остатков воды
- •Общие сведения.
- •Выполнение определения.
- •Вычисление результатов.
- •Лабораторная работа № 3 Определение кислотности воды
- •Общие сведения.
- •Необходимые реактивы
- •Выполнение определения
- •Вычисление результатов.
- •Лабораторная работа № 4 Определение щелочности природной и технической воды
- •Общие сведения
- •Щелочные компоненты различных вод
- •Необходимые реактивы
- •Выполнение определения
- •Лабораторная работа № 5 Определение общей жесткости воды трилонометрическим методом
- •Общие сведения
- •Сущность метода
- •Необходимые реактивы
- •Выполнение определения.
- •Вычисление результатов
- •Контрольные вопросы:
- •Лабораторная работа № 6 Определение кальциевой жесткости воды трилонометрическим методом
- •Общие сведения
- •Необходимые реактивы:
- •Выполнение определения
- •Вычисление результатов
- •Лабораторная работа № 7 Определение оптимальной дозы коагулянта при обработке воды
- •Общие сведения
- •Выполнение определения
- •Результаты опыта
- •Лабораторная работа № 8 Умягчение воды методом осаждения накипеобразователей.
- •Общие сведения
- •Определение необходимого расхода NaOh
- •Выполнение определения
- •Лабораторная работа № 9 Умягчение воды методом натрий-катионирования
- •Общие сведения
- •Выполнение работы
- •Процесс регенерации фильтра
- •Лабораторная работа № 10 Обессоливание воды методом ионного обмена.
- •Общие сведения
- •Лабораторные работы по курсу «Водоподготовка и водно-химические режимы тэс и аэс». Часть II. Водно-химические режимы тэс и аэс
- •Лабораторная работа № 1 Определение величины присоса охлаждающей воды в конденсатор турбины
- •Общие сведения.
- •Выполнение работы
- •Выполнение определения
- •Лабораторная работа № 2 Определение концентрации свободной угольной кислоты в воде
- •Общие сведения
- •Выполнение работы
- •Лабораторная работа № 3 Контроль состояния проточной части турбин и поверхностей нагрева парогенераторов.
- •Общие сведения
- •Контроль за состоянием проточной части турбины
- •Контроль состояния поверхностей нагрева парогенераторов
- •Лабораторная работа № 4 Определение степени загрязнённости экранных труб котла
- •Общие сведения
- •Методика определения
- •Лабораторная работа № 5 Определение скорости коррозии металла энергетического оборудования.
- •Общие сведения
- •Лабораторная работа № 6 Сепаратор spiroventair&dirt
- •Общие сведения
- •Порядок выполнения работы
- •Лабораторная работа № 7 Водно-химический режим энергоблока с котлом барабанного типа
- •Общие сведения.
- •Выполнение работы
Лабораторная работа № 2 Определение концентрации свободной угольной кислоты в воде
Цель работы: Ознакомиться с методикой определения содержания свободной угольной кислоты в водах.
Общие сведения
Свободная угольная кислота является одним из основных факторов, влияющих на процесс коррозии. Она препятствует образованию на поверхности металла пассивирующего защитного слоя, вследствие чего скорость коррозии с течением времени не уменьшается. Улекислотная коррозия носит характер равномерной (общей) коррозии, что способствует активному загрязнению теплоносителя оксидами металла. Угольная кислота понижает рН воды в процессе диссоциации:
СО2+Н2ОН++НСО3- (2.5)
Степень диссоциации увеличивается с ростом температуры, а это, в свою очередь, приводит к повышению кислотности воды и резкому возрастанию ее коррозионной агрессивности.
Вода, содержащая СО2, при комнатной температуре растворяет медь и латунь очень медленно, в присутствии же кислорода процесс коррозии активизируется.
При температуре воды 40-50оС и выше обесцинкование латуни происходит и при отсутствии кислорода.
Определение свободной СО2 основано на титровании ее раствором щелочи в присутствии индикатора фенолфталеина по реакции:
СО2+NaОН=NaHCO3 (2.6)
Титрование ведут до рН=8,4, что совпадает со слаборозовой окраской, появляющейся от одной капли раствора щелочи. Как видно из реакции (2.6), при данном pH свободная углекислота переходит в связанную форму NaНСО3, которая на процессы коррозии влияния не оказывает.
Окраска не должна исчезать при выдерживании раствора в колбе с притертой пробкой в течение 1-2 минут.
Необходимые реагенты:
раствор щелочи 0,1н концентрации;
спиртовой 1%-ный раствор фенолфталеина.
Выполнение работы
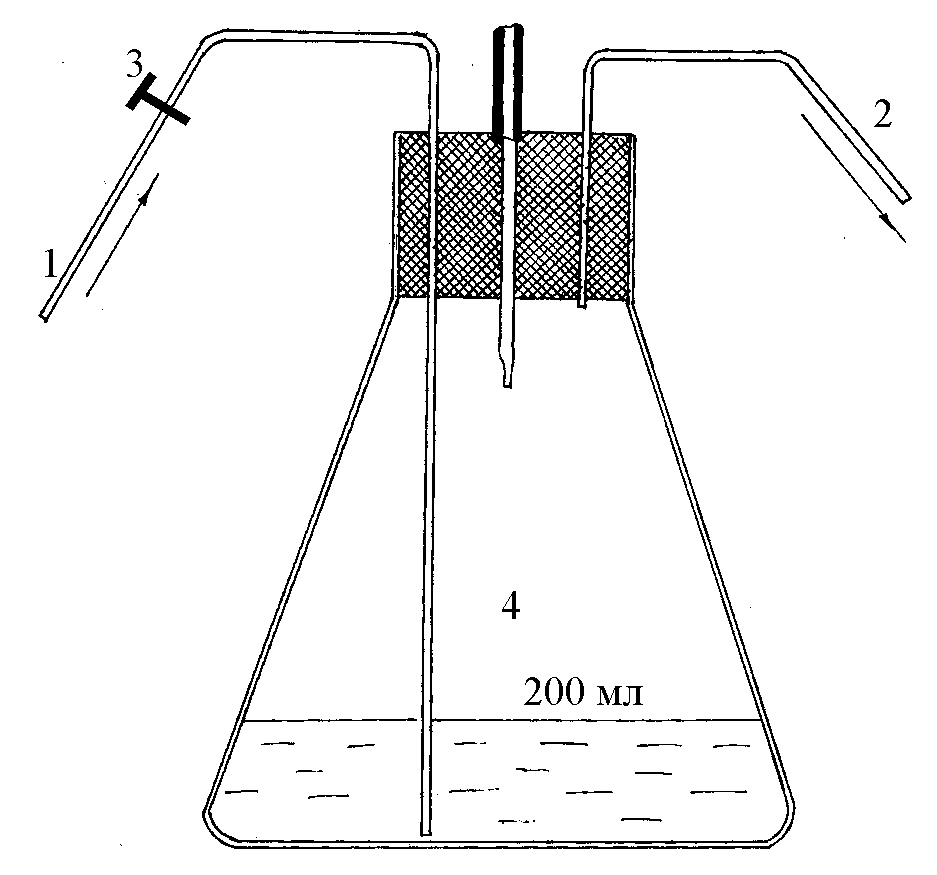
Рис. 3. Прибор для определения концентрации СО2: 1 - резиновая трубка для поступления воды; 2 - резиновая трубка для спуска воды; 3 - зажим; 4 - колба |
Присоединив прибор резиновой трубкой 1 к водопроводному крану, заполняют колбу 6 анализируемой водой, давая ей выливаться через трубку 2 до тех пор, пока через прибор не пройдет 6-7 объемов воды. После этого резиновую трубку 2 перекрывают зажимом 3, снимают трубку 2, заменяя ее хлоркальциевой трубкой, содержащей влагопоглощающее вещество.
Зажим 3 на трубке 1 ослабляют и дают воде из колбы вытекать до уровня воды в ней, соответствующей отметке 200 мл. Затем снимают хлоркальциевую трубку и отверстие закрывают резиновой пробкой.
После отбора пробы колбу переносят на лабораторный стол для титрования. Открыв резиновую пробку, в воду добавляют 2-3 капли фенолфталеина и титруют 0,1 н раствором щелочи из бюретки. Прибавление щелочи производят по каплям с перерывом для перемешивания при закрытой пробке, затем выжидают несколько секунд и снова добавляют щелочь и так до тех пор, пока не появится устойчивая слаборозовая окраска от одной капли раствора.
Количество свободной углекислоты в мг/кг, содержащейся в исследуемой воде, рассчитывают по формуле:
СО2 =
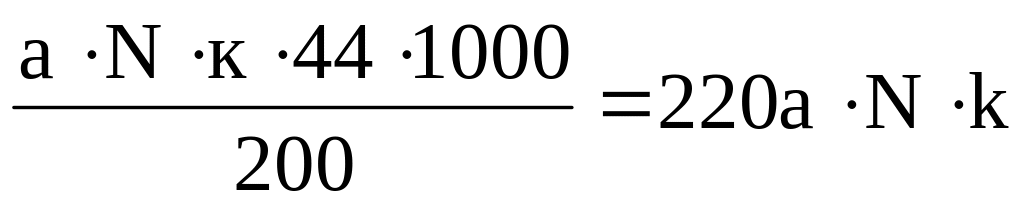 (2.7)
(2.7)
где: а-расход 0,1 н раствора NаОН на титрование, мл;
44- эквивалентная масса СО2 в данной реакции;
N-нормальность раствора NаОН;
k -поправочный коэффициент к нормальности.
Результаты опытов заносим в таблицу 2.2.
Таблица 2.2
№ п.п |
Анализируемая вода |
Расход NаОН, мл |
Величина СО2, мг/дм3 |
1. |
|
|
|
2. |
|
|
|
3. |
|
|
|
Проанализировать полученные результаты.
Контрольные вопросы:
1. Причины влияния свободной угольной кислоты на процесс коррозии?
2. Характер проявления углекислотной коррозии на поверхности металла?
3. На чем основано определение свободной СО2?
4. Почему при рН=8,4 происходит резкое снижение скорости углекислотной коррозии?
5. Основные требования к отбору пробы воды на газовый анализ?