
- •Общие методические указания
- •Химическая посуда и ее предназначение
- •Работа 1 определение молярной массы эквивалента металла методом вытеснения водорода
- •Основные теоретические положения
- •Математически закон эквивалентов для условной реакции вида
- •Порядок выполнения работы
- •Форма 1 Экспериментальные и расчетные данные
- •Давление насыщенного водяного пара при различных температурах
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 основные классы неорганических соединений
- •Основные теоретические положения
- •Оксиды – это соединения, состоящие из двух элементов, одним из которых является кислород. Образование названия оксида (его номенклатура) подчиняется следующим правилам:
- •Химические свойства кислот
- •Химические свойства солей
- •Перевод кислых (основных) солей в среднюю соль
- •Порядок выполнения работы
- •Получение и свойства гидроксидов
- •Получение и свойства кислот
- •Контрольные задания Вариант 1
- •Вариант 3
- •Вариант 4
- •Порядок выполнения работы
- •Часть 1. Определение изменения энтальпии растворения безводной соли
- •Изменение температуры калориметра для процесса растворения cоли (указать название соли)
- •Часть 2. Определение изменения энтальпии реакции нейтрализации сильной кислоты сильным основанием
- •Экспериментальные и расчетные данные для процесса нейтрализации
- •Часть 1. Определение изменения энтальпии растворения безводной соли
- •Форма 4 Экспериментальные и расчетные данные для процесса растворения соли (указать название соли)
- •Часть 2. Определение изменения энтальпии реакции нейтрализации сильной кислоты сильным основанием
- •Контрольные задания
- •Определение константы скорости и энергии активации реакции окисления йодоводородной кислоты пероксидом водорода
- •Основные теоретические положения
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные задания Вариант 1
- •Вариант 7
- •Титульный лист
- •Метрологическая карта средств измерения
- •Приложение 3 Интегральные энтальпии растворения солей в воде при 25 0с
- •Приложение 4
- •Изменение энтальпии нейтрализации 1 моль эквивалентов
- •Сильной кислоты сильным основанием при различных
- •Температурах
- •Библиографический список
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Химия Лабораторный практикум
- •Часть 1
Экспериментальные и расчетные данные для процесса нейтрализации
№ опыта |
Формулы кислоты и щелочи |
Масса кислоты mк , г |
Масса щелочи mщ , г |
Масса стакана mст , г |
Изменение температуры в опыте, С |
Концентрация кислоты СЭ, моль/дм3 |
Теплота нейтрализации Qнейтр , кДж/моль |
Н экспнейтр , кДж/моль |
Н теорнейтр , кДж/моль |
Относительная погрешность П, % |
|
tнач |
tкон |
||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
Обработка экспериментальных данных
Часть 1. Определение изменения энтальпии растворения безводной соли
1. Изменение температуры в калориметрическом опыте вычислить по формуле
t = tкон – tнач . (9)
Суммарную теплоемкость системы оценить по уравнению
Cw = [(mводы + mсоли) · Своды + mстакана · Сстекла] , Дж/К,
где mводы , mсоли , mстакана – масса воды, соли и стакана, соответственно, г; Своды , Сстекла – удельные теплоемкости воды и стекла, равные, соответственно: Своды = 4,184 Дж/г · К; Сстекла = = 0,753 Дж/г · К.
3. Тепловой эффект растворения 1 моль соли рассчитать по формуле
 ,
Дж/моль,
,
Дж/моль,
где Мсоли – молярная масса безводной соли, взятой для опыта, г/моль.
4. Записать величину изменения энтальпии растворения соли, исходя из уравнения (8):
![]()
5. По данным
параллельных опытов вычислить среднее
значение ![]() .
.
6. Выбрать теоретическое значение изменения энтальпии растворения данной соли (см. прил. 3) в зависимости от моляльной концентрации полученного раствора соли, которую оценивают по формуле
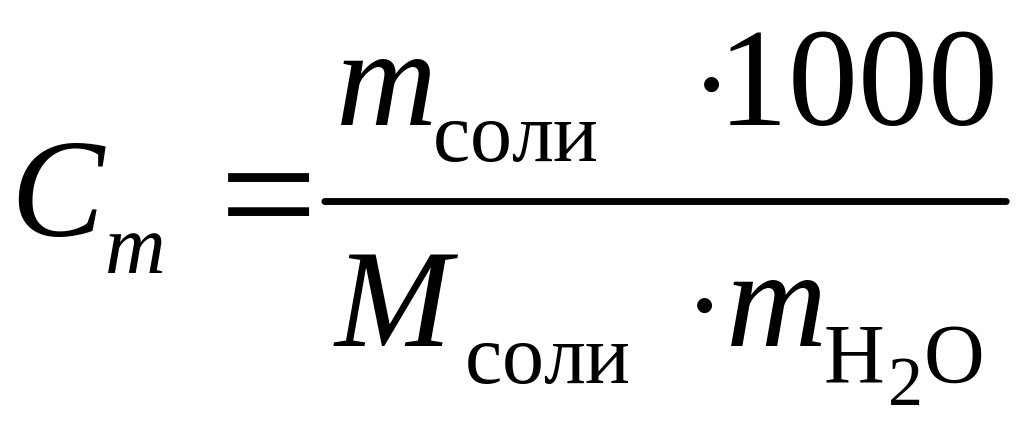 ,
моль/кг.
,
моль/кг.
7. Рассчитать относительную погрешность опыта в процентах:
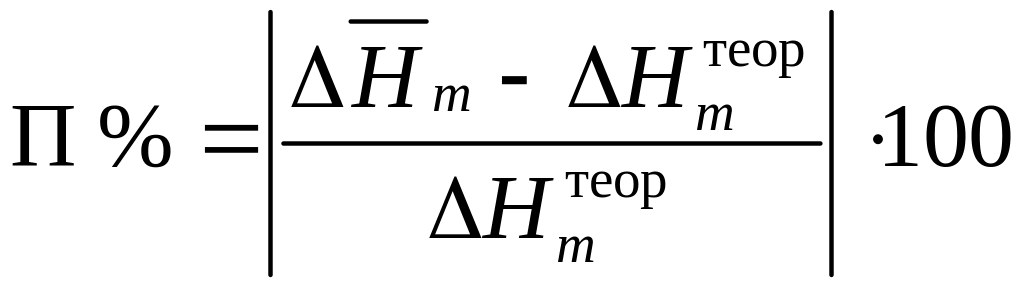 %.
%.
6. Экспериментальные данные и результаты расчетов занести в таблицу формы 4.
Форма 4 Экспериментальные и расчетные данные для процесса растворения соли (указать название соли)
№ опыта |
Мсоли , г/моль |
t, C |
Cw , Дж/К |
Q, кДж/моль |
|
|
П, % |
1 2 |
|
|
|
|
|
|
|
Часть 2. Определение изменения энтальпии реакции нейтрализации сильной кислоты сильным основанием
1. Вычислить изменение температуры в процессе нейтрализации t по формуле (9).
2. Рассчитать количество теплоты, выделившееся в результате опыта:
Q = [(mк + mщ) · Своды + mст · Сстекла] t , Дж,
где mк , mщ , mст – массы кислоты, щелочи и стакана, соответственно, г. Плотности растворов кислоты и щелочи принять равными 1 г/см3.
3. Вычислить тепловой эффект реакции нейтрализации:
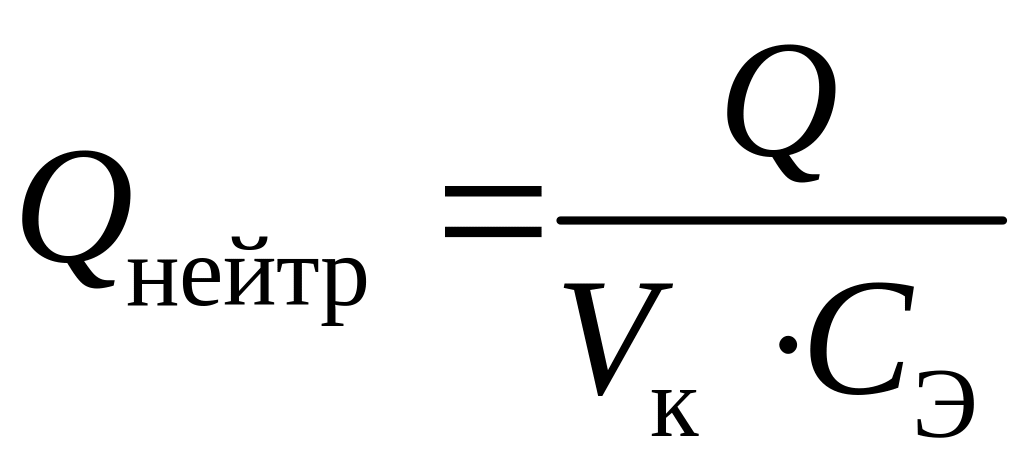 , Дж/моль,
, Дж/моль,
где Vк – объем кислоты, дм3; СЭ – молярная эквивалентная концентрация раствора кислоты, моль/дм3 (н).
4. Записать изменение энтальпии нейтрализации:
![]() .
.
5. По данным
параллельных
опытов вычислить среднее значение
![]() .
.
6. По данным прил. 4 выбрать теоретические значения изменения энтальпии нейтрализации в зависимости от температуры и определить относительную погрешность опыта в процентах:
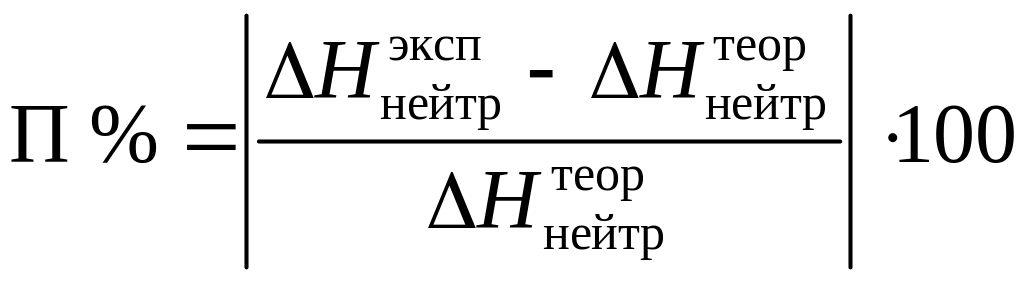 %.
%.
7. Результаты опытов и расчетные данные занести в таблицу формы 3.
8. Оформить метрологическую карту средств измерения и сформулировать выводы.
