
- •Общие методические указания
- •Химическая посуда и ее предназначение
- •Работа 1 определение молярной массы эквивалента металла методом вытеснения водорода
- •Основные теоретические положения
- •Математически закон эквивалентов для условной реакции вида
- •Порядок выполнения работы
- •Форма 1 Экспериментальные и расчетные данные
- •Давление насыщенного водяного пара при различных температурах
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 основные классы неорганических соединений
- •Основные теоретические положения
- •Оксиды – это соединения, состоящие из двух элементов, одним из которых является кислород. Образование названия оксида (его номенклатура) подчиняется следующим правилам:
- •Химические свойства кислот
- •Химические свойства солей
- •Перевод кислых (основных) солей в среднюю соль
- •Порядок выполнения работы
- •Получение и свойства гидроксидов
- •Получение и свойства кислот
- •Контрольные задания Вариант 1
- •Вариант 3
- •Вариант 4
- •Порядок выполнения работы
- •Часть 1. Определение изменения энтальпии растворения безводной соли
- •Изменение температуры калориметра для процесса растворения cоли (указать название соли)
- •Часть 2. Определение изменения энтальпии реакции нейтрализации сильной кислоты сильным основанием
- •Экспериментальные и расчетные данные для процесса нейтрализации
- •Часть 1. Определение изменения энтальпии растворения безводной соли
- •Форма 4 Экспериментальные и расчетные данные для процесса растворения соли (указать название соли)
- •Часть 2. Определение изменения энтальпии реакции нейтрализации сильной кислоты сильным основанием
- •Контрольные задания
- •Определение константы скорости и энергии активации реакции окисления йодоводородной кислоты пероксидом водорода
- •Основные теоретические положения
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные задания Вариант 1
- •Вариант 7
- •Титульный лист
- •Метрологическая карта средств измерения
- •Приложение 3 Интегральные энтальпии растворения солей в воде при 25 0с
- •Приложение 4
- •Изменение энтальпии нейтрализации 1 моль эквивалентов
- •Сильной кислоты сильным основанием при различных
- •Температурах
- •Библиографический список
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Химия Лабораторный практикум
- •Часть 1
Порядок выполнения работы
Приборы и реактивы: упрощенный калориметр, мешалка, термометр, технические весы, воронка, мерный стакан, набор мерных цилиндров; безводные соли: хлорид калия, бромид калия, нитрат калия, сульфат меди (II), карбонат натрия, иодид калия, хлорид кальция, хлорид аммония, нитрат аммония; разбавленные растворы хлороводородной кислоты, азотной кислоты, гидроксидов натрия и калия.
Х о д р а б о т ы
Часть 1. Определение изменения энтальпии растворения безводной соли
1. Получить у лаборанта навеску соли. Записать формулу и массу соли в таблицу формы 2.
2. Взять сухой калориметрический стакан, записать его массу в таблицу формы 2.
3. С помощью мерного цилиндра отмерить 70 см3 дистиллированной воды (масса 70 г, так как плотность воды 1 г/см3). Перелить воду в химический стакан и поместить его во внутренний сосуд калориметра (см. рис. 2). Данные записать в таблицу формы 2.
Форма 2
Изменение температуры калориметра для процесса растворения cоли (указать название соли)
№ опыта |
Формула соли |
mсоли , г |
mстакана , г |
mводы , г |
tнач , C |
tкон , C |
1 2 |
|
|
|
|
|
|
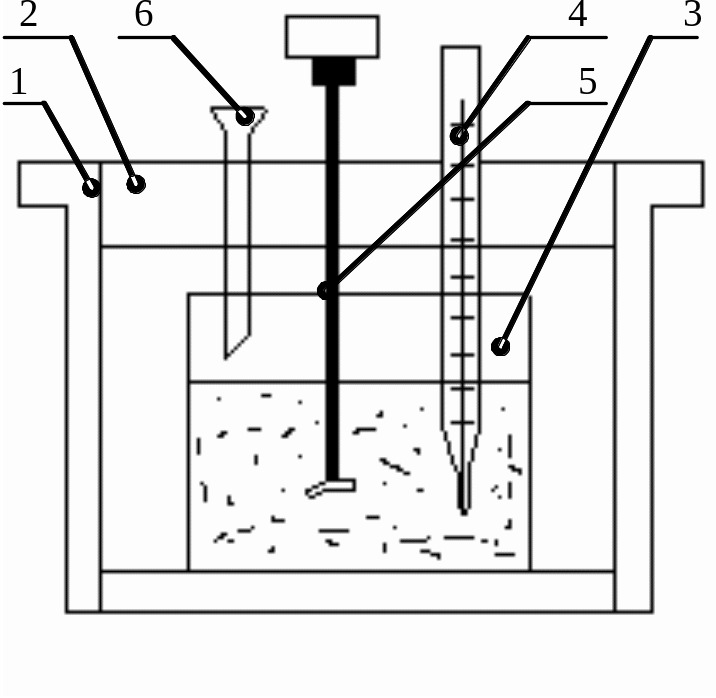
Рис. 2. Схема калориметрической установки:
1 – упрощенный калориметр; 2 – теплоизолирующая крышка с отверстиями; 3 – стеклянный стакан, масса которого известна; 4 – термометр (точность определения температуры 0,1 0С); 5 – мешалка; 6 – воронка
4. Закрыть крышку калориметра, опустив в воду мешалку. Через специальное отверстие в крышке поместить в воду термометр.
5. Через 60 с измерить начальную температуру раствора. Данные записать в таблицу формы 2.
6. Включить мешалку и через другое отверстие в крышке калориметра с помощью сухой воронки быстро внести в воду навеску соли.
7. Вынуть воронку, закрыть отверстие пробкой и в течение 1 – 2 мин следить за показаниями термометра до полной остановки столбика ртути. Конечное значение температуры записать в таблицу формы 2.
8. Выключить мешалку, вынуть стакан из калориметра.
9. Повторить опыт с другой навеской соли. Экспериментальные данные записать в таблицу формы 2.
Часть 2. Определение изменения энтальпии реакции нейтрализации сильной кислоты сильным основанием
1. По указанию преподавателя записать формулу и концентрацию кислоты в таблицу формы 3.
2. С помощью мерного цилиндра отмерить 25 см3 раствора кислоты.
3. Другим мерным цилиндром отобрать 35 см3 раствора щелочи.
4. Перелить кислоту в химический стакан и установить его в калориметр, опустить в раствор мешалку, плотно закрыть крышку калориметра.
5. В раствор кислоты поместить термометр, включить калориметр.
6. Через 60 с измерить начальную температуру раствора кислоты. Данные записать в таблицу формы 3.
7. Через воронку прилить раствор щелочи к раствору кислоты. Воронку вынуть, отверстие в крышке калориметра закрыть пробкой.
8. Зафиксировать максимальную температуру раствора. Данные записать в таблицу формы 3.
9. Выключить мешалку, вынуть стакан из калориметра.
10. Опыт повторить с такими же объёмами растворов.
Форма 3
