
- •Вопрос №1
- •Второй закон Ньютона
- •Свойства сил.
- •Скорость изменения полного импульса системы равна векторной сумме внешних сил, действующих на систему.
- •Устойчивость механической системы.
- •Уравнение моментов.
- •Релятивистская энергия
- •Нулевая масса
- •Равновесная и неравновесная система
- •Теплоёмкость.
- •Политропный процесс.
- •Равенство Квазиуса. Энтропия.
- •Распределение Больцмана.
- •Внутреннее трение. Вязкость.
Политропный процесс.
Процесс при постоянной
теплоёмкости – политропный. Найдём
уравнение политропного процесса. Так,
как С – константа, то
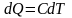 .
.
 (4.18)
(4.18)
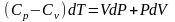

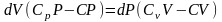
 (4.19)
(4.19)
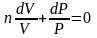 (4.20)
(4.20)
 уравнение
политропного идеального газа, n –
показатель политропы.
уравнение
политропного идеального газа, n –
показатель политропы.

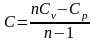 (4.22)
(4.22)
Рассмотренные ранее процессы – частные случаи политропного.
P=const n=0
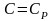
V=const
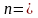
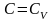
T=const n=1
C=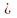
Ад
n=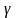 C=0
C=0
Вопрос№6
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая невозможность перехода всейвнутренней энергии системы в полезную работу.
АБСОЛЮТНАЯ ТЕМПЕРАТУРА
- одно из осн.
понятий термодинамики, введённое У.
Томсоном (Кельвином; W. Thomson) в 1848;
обозначается буквой Т. Согласно второму
началу термодинамики, 1/Т - интегрирующий
множитель для кол-ва теплоты ![]() ,
полученной системой при любом обратимом
процессе, поэтому
,
полученной системой при любом обратимом
процессе, поэтому ![]() -
дифференциал ф-ции состояния S
(энтропии)
-
дифференциал ф-ции состояния S
(энтропии)
Вопрос№7
Коэффициент полезного действия (КПД) — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии; определяется отношением полезно использованной энергии к суммарному количеству энергии, полученному системой.
КАРНО ТЕОРЕМА
- утверждает, что кпд hтепловой машины, в к-рой используется Карно цикл, <зависит только от темп-р t1 и t2 нагревателя и холодильника, <но не зависит от природы рабочего вещества. Доказана Н. Л. С. Карно (N. L. S. Carnot) в 1824. Если t1 и t2 - эмпирич. темп-ры нагревателя и холодильника, то, согласно К. т.,
h=(Q1-Q2)/Q1=f(t1, t2),
вопрос№7
Равенство Квазиуса. Энтропия.
 (6.1)
(6.1)
Квазиус показал, что
интеграл
 (6.2)
от квазистатического процесса, равенство
Квазиуса.
(6.2)
от квазистатического процесса, равенство
Квазиуса.
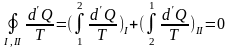 (6.3)
(6.3)
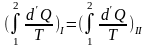 (6.4)
(6.4)
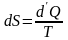 (6.5)
(6.5)
Найдём выражение для энтропии идеального газа.
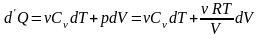
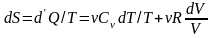 (6.6)
(6.6)
 (6.7)
(6.7)
 (6.8)
(6.8)
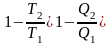 (6.9)
(6.9)
 (6.10)
неравенство Квазиуса для нестатического
процесса.
(6.10)
неравенство Квазиуса для нестатического
процесса.
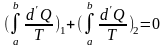 (6.12)
(6.12)
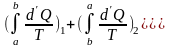 (6.13)
(6.13)
 (6.14)
(6.14)
 (6.15)
(6.15)
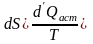 (6.16)
(6.16)
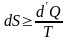 (6.17)
(6.17)
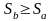 (6.19)
(6.19)
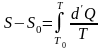 (6.20)
(6.20)
Таким образом: энтропия
адиабатически изолированной системы
может только возрастать – закон
возрастания энтропии. Этот закон
определяет направление процессов в
изолированной системе. В замкнутой
системе возможны только нестатические
процессы (выравнивание параметров).
Максимум энтропии – условие равновесия
замкнутой системы. На основе эмпирических
данных Нэрнст установил: 6.20 сходится,
при Т = 0, S=0. Приращение энтропии стремится
к определённому пределу, не зависящему
от значений других характеристик
системы. Теорема не применима для
неравновесных процессов. Абсолютный
ноль недостижим. Теорема описывает
поведение системы, при
 .
.
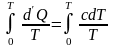 (6.21)
(6.21)

Газ в таком состоянии называется вырожденным. Уравнение Клапейрона – Менделеева для него неприменимо.
Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно.
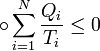
Подведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода (определяется лишь начальным и конечным состояниями системы) - дляквазистатических процессов неравенство Клаузиуса обращается в равенство[1].

Закон возрастания энтропии
Применим неравенство (44) к изолированной системе, которая никак не взаимодействует с окружающей средой. Поскольку для такой системыδ Q = 0, то (44) принимает вид:
|
(45) |
т.е. для любого процесса в изолированной системе энтропия конечного состояния не может быть меньше энтрпии начального состояния. Это –закон возрастания энтропии.
Вопрос№9
Молекулярно – кинетический смысл температуры.
Для механического равновесия поршня необходимо Р1=Р2 (8.6)

Т1=Т2
Выравнивание температур будет приводить к изменению давления, следовательно поршень движется.
В равных объёмах ИГ, при одинаковой температуре содержится равное количество молекул. P1V1=N1O1(8.16)
O/T=const k(8.17) – постоянная Больцмана.
O=kT(8.18)
P=nkT(8.19)
<Ecp>=3/2kT(8.20) – уравнение Больцмана.
Умножим 8.19 на V. PV=NkT
PV=v(kN(a))T
R=kN(a)
Вопрос№10
Равномерное распределение энергий по степеням свободы.
 (9.1)
(9.1)

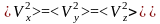
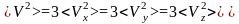

 (9.2)
(9.2)
Среднекинетическая энергия движение молекулы вдоль одной оси 1/2kT.
Для определения положения N материальных точек, необходимо задать 3n чисел. Если на движение частиц наложены ограничения, называемые связями, то количество чисел, определяющих положение системы: 3n – кол-во связей.
Число независимых координат, необходимых для определения состояния системы – число степеней свободы.
На каждую систему, находящуюся в тепловом равновесии, приходится в среднем энергия, равная 1/2kT.

Вопрос№11
Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию. Распределение Максвелла также применимо для электронных процессов переноса и других явлений. Распределение Максвелла применимо к множеству свойств индивидуальных молекул в газе.
Вопрос№12
вероятная скорость
наиболее вероятная
скорость,
![]() —
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению
—
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению
![]() .
Чтобы найти её, необходимо вычислить
.
Чтобы найти её, необходимо вычислить
![]() ,
приравнять её нулю и решить относительно
,
приравнять её нулю и решить относительно
![]() :
:
![]()

Средняя скорость
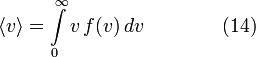
Подставляя и интегрируя, мы получим

Среднеквадратичная скорость
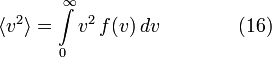
Подставляя и интегрируя, мы получим
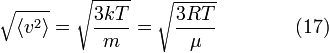
Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт явился одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра. В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление. При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего атомы начинали испаряться и летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью v, соответствующей подаваемому на концы
Вопрос№13
