
- •Вопрос №1
- •Второй закон Ньютона
- •Свойства сил.
- •Скорость изменения полного импульса системы равна векторной сумме внешних сил, действующих на систему.
- •Устойчивость механической системы.
- •Уравнение моментов.
- •Релятивистская энергия
- •Нулевая масса
- •Равновесная и неравновесная система
- •Теплоёмкость.
- •Политропный процесс.
- •Равенство Квазиуса. Энтропия.
- •Распределение Больцмана.
- •Внутреннее трение. Вязкость.
Равновесная и неравновесная система
-Если с точки зреня термодинамики, то неравновесная система стремиться стабилизировать сови характеристики: давление и температуру. У равновесной соответственно таких проблем не возникает
Термодинамика изучает пять основных процессов идеальных газов: изохорный, (v= const) происходящий при постоянном объеме газа; изобарный, (р = const) происходящий при постоянном давлении; изотермический, (Т = const) происходящий при постоянной температуре; адиабатный, (q = 0) протекающий без подвода или отвода теплоты, т.е. протекающий без теплообмена с окружающей средой;
Вопрос№2
Температура- степень теплоты, выраженная в градусах термометра
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура,давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными.
PV = nRT-уравнение Менделеева –Клапейрона
Вопрос№3
Работа идеального газа.
В результате взаимодействия системы с внешней средой, при изменении объёма будет совершаться работа. Пусть газом совершается обратимый процесс, при котором его объём изменяется от V1 до V2. dA=Fdh. dA=PSdh=PdV (3.1)
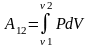 (3.2)
– справедлива для произвольного сжатия
или расширения газа.
(3.2)
– справедлива для произвольного сжатия
или расширения газа.
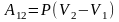 (3.3)
(3.3)
Работа не является функцией состояния, а зависит от пути перехода.
Принцип эквивалентности работы и теплоты.
Декарт, Бернулли, Ломоносов предположили возможность превращения теплоты в работу и наоборот. Строго обосновали эквивалентность механической энергии и теплоты Майер и Джоуль. Из МКТ теплопередача – выравнивание энергии колебаний молекул тела.
Передаваемая таким
образом энергия – количество теплоты.
Силу закона сохранения энергии при
циклическом процессе, работа системы
за один цикл равна полученной ей энергией.
 (3.4)
(3.4)
Внутренняя энергия. Первое начало ТД.
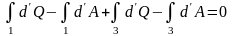 (3.5)
(3.5)
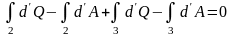
Таким образом
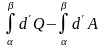 не зависит от пути, значит это функция
состояния. Введём величину U – функцию
состояния, такую, что
не зависит от пути, значит это функция
состояния. Введём величину U – функцию
состояния, такую, что
 (3.6), которая называется внутренней
энергией. С точки зрения МКТ U – энергия
системы, за вычетом кинетической энергии,
как целого, и потенциальной энергии в
поле внешних сил. В U входит кинетическая
энергия теплового движения молекул,
потенциальная энергия межмолекулярного
взаимодействия, и внутренняя энергия
молекул. Пусть системе было передано
dQ. В результате система совершила работу
dA и изменила внутреннюю энергию dU.
(3.6), которая называется внутренней
энергией. С точки зрения МКТ U – энергия
системы, за вычетом кинетической энергии,
как целого, и потенциальной энергии в
поле внешних сил. В U входит кинетическая
энергия теплового движения молекул,
потенциальная энергия межмолекулярного
взаимодействия, и внутренняя энергия
молекул. Пусть системе было передано
dQ. В результате система совершила работу
dA и изменила внутреннюю энергию dU.
 (3.7)–
математическая формулировка первого
начала ТД. Количество теплоты, полученное
системой идёт на совершение работы и
увеличение внутренней энергии.
(3.7)–
математическая формулировка первого
начала ТД. Количество теплоты, полученное
системой идёт на совершение работы и
увеличение внутренней энергии.
Вопрос№4
Теплоёмкость.
Теплоёмкостью называют физическую величину, численно равную количеству теплоты, которое необходимо сообщить системе, чтобы увеличить температуру на 1 градус.
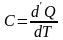 (4.1)
(4.1)
Теплоёмкость единицы массы – удельная, единицы объёма – объёмная, моля – молярная.
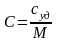 ,
,
 (4.2)
(4.2)
Из первого
начала ТД уравнение 4.1 имеет вид
 (4.3)
(4.3)
 (4.4)
(4.4)
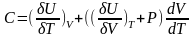 (4.5)
(4.5)
Для любого идеального газа справедливо соотношение Майера:
![]() ,
,
где ![]() — универсальная
газовая постоянная,
— универсальная
газовая постоянная, ![]() —
молярная теплоемкость при
постоянном давлении,
—
молярная теплоемкость при
постоянном давлении, ![]() —
молярная теплоемкость пр
—
молярная теплоемкость пр
вопрос№5
Уравнение Пуассона :
![]()
(y - показатель адиабаты или коэффициент Пуассона)
Уравнение Пуассона связывает параметры состояния газа приадиабатном процессе.
АДИАБАТИЧЕСКИЙ ПРОЦЕСС
(адиабатный процесс)
- термодинамич. процесс, происходящий
в системе без теплообмена с окружающей
средой ![]() ,
т. е. в адиабатически изолир. системе,
состояние к-рой можно изменить только
путём изменения внеш. параметров
,
т. е. в адиабатически изолир. системе,
состояние к-рой можно изменить только
путём изменения внеш. параметров
