
- •Скорость хим р-ции. Ср и ист скорость. Зависимость от концентрации
- •Скорость химических реакций в гетерогенных системах. Катализ.
- •Химическое равновесие в гомогенных и гетерогенных системах. Константа…
- •Принцип Ле-шателье
- •Физические и химические свойства воды. Диаграмма состояния воды.
- •Законы Рауля и Вант-Гоффа для растворов неэлектролитов
- •Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты. Активность ионов.
- •Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
- •Ионное произведение воды. РН растворов. Произведение растворимости.
- •Поверхностные явления
- •Дисперстные системы
- •Жёсткость воды и способы её устранения
- •Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
Принцип Ле-шателье
Установившееся равновесие характеризуется определенными соотношениями концентраций веществ. Но состав равновесной смеси можно изменить, изменяя температуру системы, концентрации веществ и давление. Изменение состояния равновесия в результате изменения условий принято называть смещением химического равновесия. Принцип Ле-Шателье позволяет предсказать, в какую сторону будет смещаться равновесие системы при изменении внешних условий.
Принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказывают внешнее воздействие путем изменения какого-либо из условий, определяющих положение равновесия (Т, V, P), то оно смещается в направление того процесса, протекание которого ослабляет эффект произведенного воздействия (смещается в сторону ослабления этого воздействия). Пример: определить в каком направлении сместится равновесие в следуещей системе: 4HCL(г) + O2(г) <=> 2CL2(г) + 2H2O(г); delta.rH0= -114 кДж а)при повышении температуры, б)при повышении концентрации, в)при повышении давления. Ответ: а)при увеличении Т равновесие экзотермической реакции смещается влево, б) вправо, т.к. при увеличении концентрации любого исходного в-ва равновесие смещается вправо, а продукта реакции – влево, в)при увеличении давления равновесие смещается в сторону меньшего числа газовых молей. Было 5 моль <=> 4 моль, значит вправо.
Физические и химические свойства воды. Диаграмма состояния воды.
Молекула воды имеет угловое строение, входящие в ее состав атомы образуют равнобедренный треугольник, в основании которого находятся два атома водорода, а в вершине - атом кислорода. Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого в жидкое состояние не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4оС плотность ее также увеличивается. При 4оС вода имеет максимальную плотность ( 1.0 гсм3 ), и лишь при дальнейшем нагревании ее плотность уменьшается (при 20 0С 0,9982 гсм3 ). Это объясняется тем, что при плавлении льда его структура разрушается и при этом упаковка молекул воды становится более плотной. Поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность увеличивается.
При нагревании воды с интервалом температур от 0 до 4оС эффект разрушения структуры льда и уплотнение молекул воды преобладает над тепловым расширением и плотность воды продолжает возрастать. При нагревании выше 4оС происходит усиление движения молекул, и плотность воды уменьшается. Вода по сравнению с другими соединениями обладает более высокой теплоемкостью 4,18 Дж/гК. ( Теплоемкость других веществ, Дж/гК: SO2 - 0,79, CаСО3 - 0,88, NaCl - 0,88, глицерин - 2,43, этиловый спирт - 0,85). При нагревании воды часть энергии затрачивается на разрыв водородных связей (энергия водородной связи в воде составляет ~ 25 кДж/моль) - этим объясняется высокая теплоемкость воды. Полностью водородные связи разрываются только при переходе воды в пар.
Молекулы воды отличаются устойчивостью к нагреванию. Однако при температурах выше 1000оС водяной пар начинает разлагаться: 2Н2О <=> 2Н2 + О2 Данный процесс называется термической диссоциацией. Поскольку диссоциация воды происходит с поглощением тепла, то согласно принципу Ле Шателье с повышением температуры процесс термической диссоциации смещается в сторону образования водорода и кислорода. Однако даже при 2000оС степень термической диссоциации не превышает 2%. При температурах ниже 1000оС равновесие сдвигается в сторону образования воды.
Вода является очень реакционно-способным веществом:
SO2 + H2O = H2SO3 SO3 + H2O = H2SO4 N2O5 + H2O = 2HNO3
CaO + H2O = Ca(OH)2 Na2O+ H2O = 2NaOH CuSO4 + 5H2O = CuSO4 · 5H2O Na2SO4 + 10H2O = Na2SO4 · 10H2O 3Fe + 4H2O = Fe3O4 + H2 PCl3 + 3H2O = H3PO3 + 3HCl 2Na +2H2O = 2NaOH + H2
Вода обладает каталитической способностью
2Ме
+ Сl2
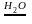 2MeCl
2MeCl
Вода способна соединяться с рядом веществ, находящихся в обычных условиях в газообразном состоянии, образуя при этом так называемые гидраты газов.
Xe + 6Н2О = Xe · 6Н2О
Сl2 + 8H2O = Cl2 · 8H2O
Данные соединения выпадают в виде кристаллов в температурном интервале 0 – 24 оС. Подобные соединения возникают в результате заполнения молекулами газа межмолекулярных полостей, имеющихся в структуре воды, такие соединения называются клатратами.
Вода может существовать в трех агрегатных состояниях (парообразном, жидком и шести кристаллических), каждое из которых устойчиво в определенных интервалах температуры и давления. Такие системы, т.е. представленные одним веществом, находящимся в различных агрегатных состояниях, называются однокомпонентными. Точка К - является критической точкой воды. Выше температуры 646 К вода при давлении больше 219,82·102 кПа не может находится в жидком состоянии. Выше данной температуры ни при каком давлении не происходит разделения на газообразную и жидкую фазы. В областях, лежащих за пределами кривой давления насыщенного пара и критической точки можно осуществить непрерывный переход жидкости в пар и пара в жидкость Ж <=> П. При замерзании воды ее объем увеличивается, что объясняется содержанием в кристаллической структуре льда большого количества пустот. При плавлении льда эта структура разрушается, и пустоты заполняются молекулами жидкой воды, в результате чего ее объем уменьшается.
