
- •Скорость хим р-ции. Ср и ист скорость. Зависимость от концентрации
- •Скорость химических реакций в гетерогенных системах. Катализ.
- •Химическое равновесие в гомогенных и гетерогенных системах. Константа…
- •Принцип Ле-шателье
- •Физические и химические свойства воды. Диаграмма состояния воды.
- •Законы Рауля и Вант-Гоффа для растворов неэлектролитов
- •Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты. Активность ионов.
- •Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
- •Ионное произведение воды. РН растворов. Произведение растворимости.
- •Поверхностные явления
- •Дисперстные системы
- •Жёсткость воды и способы её устранения
- •Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
Скорость хим р-ции. Ср и ист скорость. Зависимость от концентрации
В общем случае все реакции можно подразделить на гомогенные и гетерогенные. Гомогенные реакции протекают в объеме одной фазы: газообразной или жидкой. Гетерогенные реакции протекают на поверхности раздела нескольких фаз (газ-твердое, жидкость –твердое, две несмешивающиеся жидкости). Примером гомогенной реакции является взаимодействие H2 и О2 с образованием Н2О: 2H2г + О2г = 2Н2Ог, или реакция синтеза аммиака: 3H2г + N2г = 2NH3г, горение газообразного топлива: CH4 + 2O2 = CO2 + 2H2O Чаще встречаются гетерогенные реакции, к которым относят процессы коррозии, горения твердого топлива, процессы твердения вяжущих веществ и др.
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции):
V=
DС/Dt,
(моль/л·с; моль/л·мин)
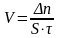 ,
(моль/м2·с;
моль/ м2·мин)
,
(моль/м2·с;
моль/ м2·мин)
где V - скорость химической реакции; DС – изменение концентрации вещества; Dt – промежуток времени. Для гомогенной химической реакции скорость измеряется изменением концентрации одного из веществ в единицу времени. Если концентрация С выражается в моль/л, а время - в мин или с, то размерность скорости реакции моль/л·с или моль/л·мин. В химической кинетике различают среднюю и истинную скорость (мгновенную).
Средняя скорость реакции принимается всегда положительной величиной
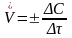 ;
знак " - " ставят в тех случаях,
когда скорость реакции рассчитывают
по исходным веществам, концентрация
которых со временем уменьшается (рис.
1). ∆С = С1
- С0
< 0, ∆τ = τ1
- τ0
∆С
= С1
- С0>0.
Ззнак " + " - когда скорость
рассчитывается по продуктам реакции:
∆С = С1
- С0>0.
;
знак " - " ставят в тех случаях,
когда скорость реакции рассчитывают
по исходным веществам, концентрация
которых со временем уменьшается (рис.
1). ∆С = С1
- С0
< 0, ∆τ = τ1
- τ0
∆С
= С1
- С0>0.
Ззнак " + " - когда скорость
рассчитывается по продуктам реакции:
∆С = С1
- С0>0.
где С0 - исходная концентрация веществ, во время τ0, С1 - кон центрация веществ в последующий момент времени τ1.
Зависимость скорости реакции от концентрации
реагирующих вещест
Чтобы реакция имела место, необходимо, чтобы произошло столкновение между молекулами. Модель, объясняющая изменение скорости реакций, называется теорией столкновений. Эта теория позволяет понять влияние концентрации на скорость гомогенных реакций. Для реакций взаимодействия газообразных веществ А и В по схеме А + В → АВ, только столкновение молекул А и В может привести к химическому взаимодействию, т.к. столкновение молекул А - А и В - В не сопровождается превращением в конечный продукт АВ. В 1867 году был сформулирован закон, согласно которому для произвольной гомогенной реакции: mAг + nBг = рСг + qDг при постоянной температуре скорость химической реакции (v), прямо пропорциональна произведению концентраций реагирующих веществ (СА и СВ), взятых в степенях, равных стехиометрическим коэффициентам (m и n) в уравнении реакции:
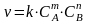 где:
к
-
коэффициент пропорциональности,
называемый константой скорости химической
реакции. Это выражение называется
законом действующих масс. Уравнение,
выражающее связь концентраций реагирующих
веществ со скоростью химических реакций
называется кинетическим уравнением
скорости химических реакций. Константа
скорости реакции зависит от тех же
факторов, что и скорость данной реакции,
а именно: от природы реагирующих веществ,
от температуры, от присутствия
катализатора, но не зависит от концентрации
исходных веществ, участвующих в реакции.
Константа скорости характеризует
способность веществ взаимодействовать
друг с другом. Физический смысл константы
скорости заключается в том, что v
= k,
если:
где:
к
-
коэффициент пропорциональности,
называемый константой скорости химической
реакции. Это выражение называется
законом действующих масс. Уравнение,
выражающее связь концентраций реагирующих
веществ со скоростью химических реакций
называется кинетическим уравнением
скорости химических реакций. Константа
скорости реакции зависит от тех же
факторов, что и скорость данной реакции,
а именно: от природы реагирующих веществ,
от температуры, от присутствия
катализатора, но не зависит от концентрации
исходных веществ, участвующих в реакции.
Константа скорости характеризует
способность веществ взаимодействовать
друг с другом. Физический смысл константы
скорости заключается в том, что v
= k,
если:
а) произведение концентраций СА и СВ равно 1 или б) СА = СВ = 1 (моль/л).
Пример Реакция между веществами А и В выражается уравнением Аг + 2Вг = 2Сг.
Константа скорости этой реакции равна 0,1. Начальная концентрация реагирующих веществ СА = 0,4 моль/л; СВ = 0,8 моль/л. Вычислить, во сколько раз изменится скорость реакции, если концентрация вещества А уменьшилась на 0,1 моль/л.
РЕШЕНИЕ: Начальная скорость реакции, согласно закону действующих масс, выражается уравнением:
v0=
к1СА·С =
0,1·0,4·0,82
= 0,0256моль/л·с
=
0,1·0,4·0,82
= 0,0256моль/л·с
Согласно уравнению реакции 1 моль вещества А реагирует с 2 моль вещества В. Следовательно, уменьшение концентрации вещества А на 0,1 моль/л, в результате протекающей химической реакции сопровождается снижением концентрации вещества В на 2 х 0,1 моль/л. Тогда:
v1 =0,1(0,4 - 0,1)·(0,8 - 2х0,1)2 =0,0108 моль/л
Тогда v0/ v 1=0,0256/0,0108=2,37
Ответ,: При уменьшении концентрации вещества А на 0,1моль/л скорость реакции уменьшилась в 2,37раза.
Поскольку концентрации реагирующих веществ в ходе химической реакции изменяются, средняя скорость реакции зависит от промежутка времени, за который она определена. Если изменение времени бесконечно мало, то такая скорость реакции будет называться истинной скоростью реакции, т.е. истинная скорость реакции:
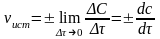 =
tgα
Таким образом, истинная скорость реакции
– это скорость расходования исходных
веществ или образования продуктов
реакции в данный момент времени
=
tgα
Таким образом, истинная скорость реакции
– это скорость расходования исходных
веществ или образования продуктов
реакции в данный момент времени
