
- •Скорость хим р-ции. Ср и ист скорость. Зависимость от концентрации
- •Скорость химических реакций в гетерогенных системах. Катализ.
- •Химическое равновесие в гомогенных и гетерогенных системах. Константа…
- •Принцип Ле-шателье
- •Физические и химические свойства воды. Диаграмма состояния воды.
- •Законы Рауля и Вант-Гоффа для растворов неэлектролитов
- •Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты. Активность ионов.
- •Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
- •Ионное произведение воды. РН растворов. Произведение растворимости.
- •Поверхностные явления
- •Дисперстные системы
- •Жёсткость воды и способы её устранения
- •Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
Скорость химических реакций в гетерогенных системах. Катализ.
К гетерогенным химическим реакциям относят процессы коррозии, твердения вяжущих материалов, процессы горения кускового топлива (С + О2 = СО2). Реакции в гетерогенных системах осуществляются на поверхности раздела фаз. Cредняя и истинная скорость гетерогенной реакции м.б. представлена соответственно как:
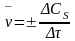 и
и
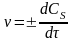
или v = K'S·C = к"СS
где S - суммарная поверхность, приходящаяся на единицу массы твердого вещества (м2/г). Условно механизм протекания гетерогенных реакций можно подразделить на 4 этапа:
1)подвод исходных веществ к границе раздела фаз (т.е. диффузия исходных веществ к зоне реакции), пример: CO2(г)+CaO(к)=CaCO3(к);
2)адсорбция газообразного или жидкого вещества поверхностью твердого вещества на границе раздела фаз;
3)химическое взаимодействие реагирующих веществ;
4)отвод (диффузия) продуктов реакции из зоны взаимодействия. Скорость гетерогенной химической реакции будет определяться самой медленной из составляющих процесс взаимодействия стадий.
При этом возможны 3 случая:
а) если диффузия протекает быстро, а скорость химической реакции мала, то последняя протекает в кинетической области (т.е. в области самой химической реакции, описываемой кинетическим уравнением);
б) если диффузия протекает медленно, а скорость химической реакции велика, то последняя протекает в диффузионной области (т.е. в области подвода реагентов или отвода продуктов реакции, описываемой уравнениями диффузии веществ);
в) если скорости процессов сопоставимы, то говорят, что реакция протекает в кинетическо-диффузионной области.
Катализ. Скорость химических реакций значительно возрастает в присутствии катализатора. Катализаторы – химические вещества, которые ускоряют химические реакции за счет образования активированного комплекса, снижающего энергию активации протекающей реакции, но не испытывающего химического превращения в ее результате. Явление изменения скорости реакции под воздействием катализатора называется катализом. Механизм действия катализатора можно рассмотреть на примере. Гомогенный катализ 2SO2+O2=2SO3, катализатор NO(г). В присутствии катализатора (оксид азота (II)). Механизм реакции изменяется следующим образом:
1) O2г + 2NOг = 2NO2г
2) SO2г + 2NO2г = 2SO3г + 2NOг
Складывая уравнения (1) и (2) приходим к уравнению:
2SO2г + O2г = 2SO3г
Причиной ускорения катализируемых химических реакций является снижение энергии активации катализатором и, как следствие, возрастание скорости химической реакции. Примером гетерогенного катализа является процесс образования аммиака по реакции N2+3H2стрелки2NH3.
Химическое равновесие в гомогенных и гетерогенных системах. Константа…
Все химические реакции можно разделить на два вида: необратимые и обратимые. Необратимые реакции протекают до полного исчезновения одного или нескольких реагирующих веществ. Примером необратимой реакции может быть реакция разложения нитрата аммония: NH4NO3 =N2O + 2H2O.
Реакции, которые при одной и той же температуре в зависимости от соотношения реагентов могут протекать как в прямом, так и в обратном направлении, называются обратимыми.
Примером обратимой реакции может быть реакция взаимодействия водорода с газообразным иодом: Н2 (г) + I 2 (г) < = > 2HI (г)
В данной обратимой гомогенной химической реакции соотношение скоростей прямой и обратной реакций, согласно закону действующих масс, зависит от соотношения концентраций реагирующих веществ. Скорость прямой реакции выражается уравнением:

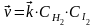 ,
,
где
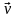 - скорость прямой реакции, моль·л-1·с-1;
- скорость прямой реакции, моль·л-1·с-1;
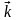 -
константа скорости прямой реакции;
-
константа скорости прямой реакции;
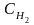 и
и -
концентрации водорода и иода, моль·л-1;
-
концентрации водорода и иода, моль·л-1;
скорость обратной реакции:
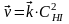
где - скорость обратной реакции, моль·л-1·с-1;
- константа скорости обратной реакции;
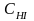 -
концентрация иодоводорода, моль·л-1.
-
концентрация иодоводорода, моль·л-1.
По мере прохождения реакции наступает такой момент времени, когда скорости прямой и обратной реакции окажутся равными. Такое состояние системы называется состоянием химического равновесия, т.е. число образуемых и распадающихся молекул HI в единицу времени и в единицу объема становится одинаковым. Химическое равновесие является динамическим равновесием. При химическом равновесии концентрации всех участников реакции постоянны и не изменяются со временем, хотя одновременно осуществляется прямая и обратная реакции. Константа равновесия. Отношение скоростей прямой и обратной реакции для данной температуры является постоянным и называется константой
равновесия для данной реакции. В выражении константы равновесия записываются концентрации или давления газообразных или жидких веществ, твёрдые вещества в выражение константы не записываются. Пример: N2(г) + 3H2(г) < = > 2NH3(г) Кс=С2NH3\C2H2 x CN2
