
- •Побудова графиків. 8
- •Визначення коефіцієнтів рівняння прямої графічним шляхом. 15
- •1. Методи наближених обчислювань
- •2. Побудова графиків
- •Приклад побудови графіка
- •3. Визначення коефіцієнтів рівняння прямої графічним шляхом
- •Рішення
- •4. Метод найменших квадратів
- •Визначаємо питому та молярну електропровідність. Результати розрахунку наведені в таблиці 4.2.
- •Вихідні дані та результати розрахунку питомої та молярної електропровідності оцтової кислоти
- •5. Надійний інтервал
- •Значення критерію Стьюдента для розрахунку надійних границь
- •Приклад 5.1. Використуйте метод найменших квадратів для побудови калібрувального графіка при спектрофотометрічному визначенні тропеоліну та обчислите надійний інтервал оцінки регресії.
- •Рішення
- •6. Інтерполювання функцій
- •Рішення
- •Кінцеві різниці
- •7. Чисельне диференціювання
- •Кінцеві різниці
- •Оскільки температура 356,5 к знаходиться ближче до початку таблиці, використовуємо при розрахунку формулу (42):
- •Список літератури
4. Метод найменших квадратів
При обробці експеріментальних даних – чисельної залежності y = f(x) – часто необхідно обчислити коефіцієнти лінійної залежності:
Y = a·x + b (25)
Просте графічне рішення таких задач є незадовільним, оскільки побудування прямої є суб’єктивним процесом. Лише математична обробка дозволяє об’єктивно визначити розташування прямої. Тому краще встановити математичне співвідношення вида (25). Коефіцієнти цього лінійного многочлена розраховують методом найменших квадратів, тобто так, щоб сума квадратів відхилень досвідних значень уi від значень Yi (i = 1, 2, 3, ……, n), обчислених за рівнянням (17), була мінімальною:
![]() (26)
(26)
Система рівнянь для визначення а та b має вигляд
 (27)
(27)
Вирішив цю систему знайдемо шукаємі параметри:
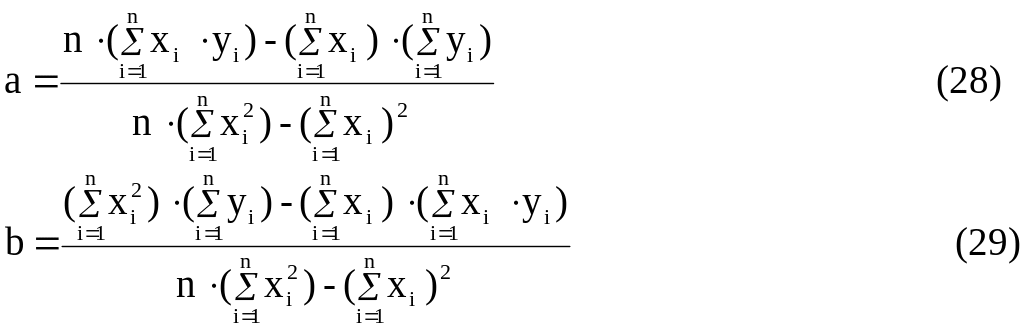
Для характеристики сили кореляціоного зв’язку між величинами х та у необхідно обчислити коефіцієнти кореляції:
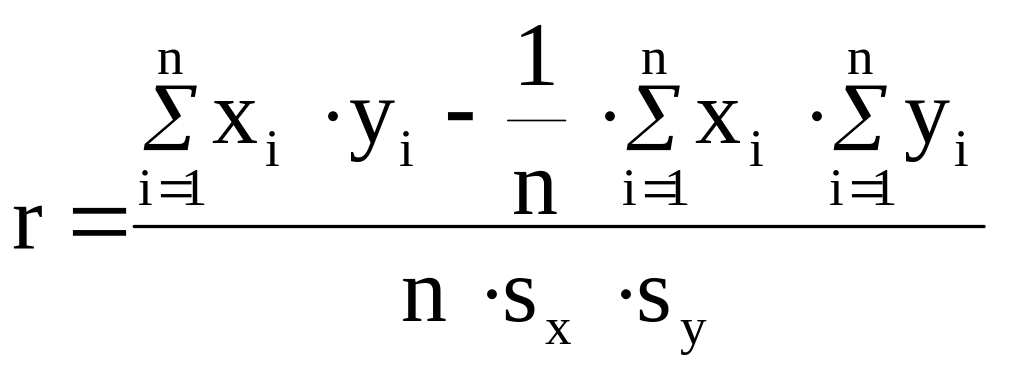 (30)
(30)
де sx і sy – середні квадратичні відхилення:
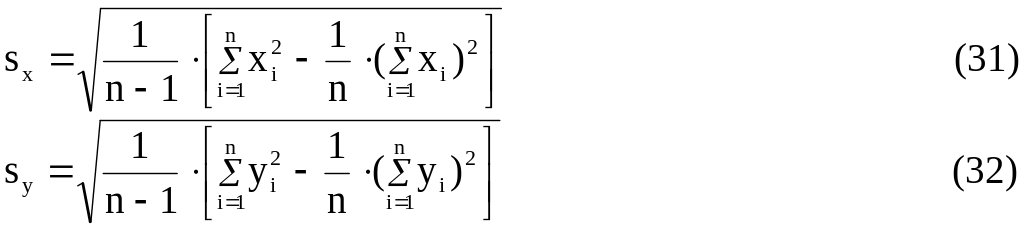
Цей розрахунок можна провести вручну (див. приклад 2.1) за формулами (27) – (32), або застосував стандартні комп’ютерні програми Excel, Origin, Sigma Plot.
Приклад 4.1. По залежності питомого опору розчину оцтової кислоти від концентрації при 25°С розрахуйте константу дисоціації.
Таблиця 4.1
Залежність питомого опору розчину оцтової кислоти від концентрації
-
C(CH3COOH), моль/м3
1,00
3,00
5,00
10,00
30,00
50,00
100,00
r, Ом·м
185
103
87,0
61,0
34,8
27,6
19,6
Рішення
Визначаємо питому та молярну електропровідність. Результати розрахунку наведені в таблиці 4.2.
Таблиця 4.2
Вихідні дані та результати розрахунку питомої та молярної електропровідності оцтової кислоти
-
C(CH3COOH), моль/м3
r, Ом·м
χ, Ом-1·м-1
χ = r-1
λ, м2/Ом·моль
λ = χ/c
1/ λ
1
185
0,005405
0,005405
185
3
103
0,009709
0,003236
309
5
87,0
0,011494
0,002299
435
10
61,0
0,016393
0,001639
610
30
34,8
0,028736
0,000958
1044
50
27,6
0,036232
0,000725
1380
100
19,6
0,05102
0,00051
1960
Наведемо
рівняння
![]() в лінійній формі:
в лінійній формі:
![]()
де λ0 – гранична молярна електропровідність розчину оцтової кислоти:
λ0 = λ0+ + λ0- = 0,03498 + 0,00409 = 0,03907 м2/Ом·моль.
Таким
чином, залежність молярної електропровідності
від концентрації є лінійною в координатах
λ·C – 1/λ. Зіставив рівняння (25) і (33),
позначимо х = 1/λ, у = λ·C,
![]() та b =
та b =
![]() .
Розрахуємо ці значення за рівняннями
(28) та (29). Результати розрахунку наведені
в таблиці 4.3.
.
Розрахуємо ці значення за рівняннями
(28) та (29). Результати розрахунку наведені
в таблиці 4.3.
Таблица 4.3
Вихідні дані та результати обчислювань коефіцієнтів системи рівнянянь (27)
-
№
х
у
(хi)2
(уi)2
xi·уi
1
206
0,00485
42436
2,36·10-5
1,00
2
348
0,00862
121104
7,43·10-5
3,00
3
445
0,01124
198025
0,000126
5,00
4
624
0,01603
389376
0,000257
10,00
5
1113
0,02695
1238769
0,000727
30,00
6
1380
0,03623
1904400
0,001313
50,00
7
1950
0,05128
3802500
0,00263
100,00
Суми
6066
0,15521
7696610
0,00515
199,00
Підставив обчислені суми в рівняння (28) і (29), розрахуємо коефіцієнти многочлена:
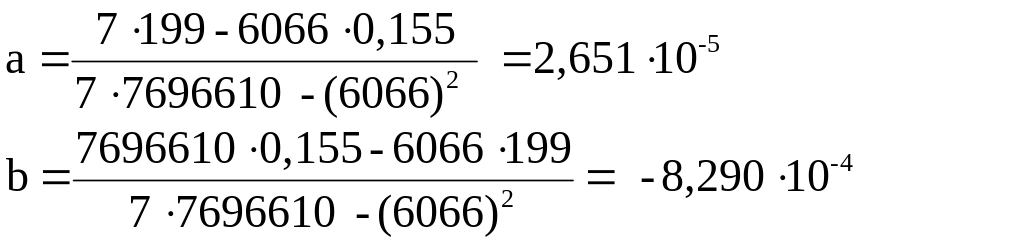
Таким чином, коефіцієнти лінійного многочлена а = 2,651 · 10-5; b = -8,290 · 10-4. Знаючи коефіцієнт а, котрий згідно (33), дорівнює
![]()
обчислимо константу дисоціації оцтової кислоти
![]()
Розрахуємо середні квадратичні відхилення за формулами (31) та (32)

і коефіцієнт кореляції за формулою (30)

