- •Побудова графиків. 8
- •Визначення коефіцієнтів рівняння прямої графічним шляхом. 15
- •1. Методи наближених обчислювань
- •2. Побудова графиків
- •Приклад побудови графіка
- •3. Визначення коефіцієнтів рівняння прямої графічним шляхом
- •Рішення
- •4. Метод найменших квадратів
- •Визначаємо питому та молярну електропровідність. Результати розрахунку наведені в таблиці 4.2.
- •Вихідні дані та результати розрахунку питомої та молярної електропровідності оцтової кислоти
- •5. Надійний інтервал
- •Значення критерію Стьюдента для розрахунку надійних границь
- •Приклад 5.1. Використуйте метод найменших квадратів для побудови калібрувального графіка при спектрофотометрічному визначенні тропеоліну та обчислите надійний інтервал оцінки регресії.
- •Рішення
- •6. Інтерполювання функцій
- •Рішення
- •Кінцеві різниці
- •7. Чисельне диференціювання
- •Кінцеві різниці
- •Оскільки температура 356,5 к знаходиться ближче до початку таблиці, використовуємо при розрахунку формулу (42):
- •Список літератури
2. Побудова графиків
Основні вимоги до побудови графіків:
побудова графіків виконується простим олівцем на міліметровому папері;
графік повинен бути по-можливості більш квадратним (крім окремих випадків) з розмірами сторін 100 – 150 мм; при необхідності підкреслити характерні риси в зміні функції (наявність максимуму, мінімуму, точки перегину можна стиснути графік по осі X або витягнути по осі Y;
масштаб осей повинен бути обраний таким чином, щоб проведені через точки прямі або криві займали максимально відведену осями координат площу (Рис. 1);
немає необхідності починати осі з нульового значення, якщо це не викликано, наприклад, необхідністю графічної екстраполяції з метою знаходження y при x=0;
осі повинні починатися з того значення, що є ближнім до найменшого округленого й кінчатися найближчим до найбільшого округленого значення масиву даних. Так, якщо значення Х міняється від 0,53 до 0,97, то вісь абсцис доцільно обмежити ліворуч значенням 0,5, а праворуч 1,0;
звичайно вісь абсцис (вісь Х) розташовується в нижній частині графіка, а вісь ординат (вісь Y) – у лівій. Ця вимога поширюється також на випадок даних з негативними значеннями;
як опорні точки при розмітці осей варто вибирати не дослідні, а округлені й рівновіддалені друг від друга значення x і y, що відрізняються друг від друга на 1, 2 або 5 одиниць або цих значень помножені на 10n (Рис. 1а,б);
осі підписуються, або уздовж осей поза графіком (Рис. 1а), або наприкінці осей (Рис. 1б);
назва осей включає позначення величин і через кому їхня розмірність;
точки на графіку повинні бути добре помітні й наносяться у вигляді геометричних фігур (кружечки, квадратики й т.д.);
якщо на одному графіку розташовується кілька кривих, то кожна повинна мати свій тип точки;
якщо нанесені на графік точки повинні теоретично підкорятися лінійної залежності, то через них проводять усереднену пряму за допомогою лінійки, в інших випадках лінія проводиться плавно від руки або під лекало.
|
|
Приклад побудови графіка
Необхідно побудувати графік залежності величини логарифма тиску насиченої пари води від зворотної температури за наступним даними:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
1/T, K-1 |
0,00270 |
0,00272 |
0,00274 |
0,00277 |
0,00281 |
0,00286 |
0,00290 |
ln(P, Па) |
11,570 |
11,385 |
11,220 |
11,003 |
10,762 |
10,453 |
10,070 |
Найбільш відповідальною задачею при побудові графіка є вибір масштабу координатних осей. Існує кілька алгоритмів рішення цієї задачі. Однак, багато хто з них вимагають наявності практичних навичок. Наведений вище приклад є досить складним, тому що зміни значень 1/Т спостерігається в четвертому знаку після коми, а зміна значень ln(P) становить одиниці. Нижче наведений алгоритм побудови графіків з будь-якими значеннями аргументів.
На міліметровому папері проводимо координатні осі довжиною 100 – 150 мм. Візьмемо, наприклад, осі довжиною 120 мм. Нанесемо на них по двох риски: одну на відстані 10 мм, а іншу – 110 мм від точки перетинання осей. Першої рисці буде відповідати мінімальне, а другий – максимальне значення масиву даних. Відстань між ними в нашому випадку буде становити Lx=Ly=110-10 =100мм. Таким чином, точки графіка будуть розташовуватися в області ABCD (Рис. 2).
Визначимо масштаб осі Х. Проаналізуємо дані 1/Т и виберемо мінімальне й максимальне значення: xmin=0,00270, xmax=0,00290. Розрахуємо ціну ділення (одного міліметра) міліметрового паперу по осі Х: mx=(xmax - xmin)/Lx = 0,00290-0,00270/100 = 2,010-6 K-1·мм-1.
Визначимо масштаб осі Y. Проаналізуємо дані ln(P) і виберемо мінімальне й максимальне значення: ymin=10,070, ymax=11,570. Розрахуємо ціну ділення по осі Y: my=(ymax – ymin)/Ly = 11,570-10,070/100 = 0,015 мм-1.
Знаходження положення точки на графіку полягає в тім, що для кожної точки визначається відстань на яке необхідно відступити (з урахуванням масштабу mx і my) від риски xmin вправо по осі Х и від риски ymin нагору по осі Y. Величина відступу в міліметрах від xmin по осі Х для точки з координатою х дорівнює lx = (x – xmin)/mx, а відступ у міліметрах від ymin по осі Y для точки з координатою y дорівнює ly = (y – ymin)/my;
Знайдемо відступ по осі Х и Y для точки 4 з координатами 1/Т=0,00277 і ln(P)=11,00276: lx=(0,00277-0,00270)/2,010-6=35 мм, ly= (11,003-10,070)/0,015 = 62 мм;
Відкладемо на осі абсцис (X) від риски xmin відрізок довжиною 35 мм, а на осі ординат (Y) від ymin відрізок довжиною 62 мм. На перетинанні перпендикулярів, відновлених з відкладених на осях крапок знайдемо положення точки 4 (Рис. 3).
Положення інших крапок на графіку перебуває аналогічно п.5 – п.6;
Через нанесені на графік точки проводимо плавну криву, або за допомогою лінійки пряму залежно від передбачуваного виду залежності;
Підписуємо осі й одержуємо графік, що представлен на рис. 4.
|
Рис. 3. |
|
|
Визначення координати довільної точки на графіку.
Наприклад, необхідно знайти координати точки K, узятої на прямій побудованого нами графіка. Дана задача є зворотньою побудові графіка. Вирішується вона в такий спосіб:
Опускаємо проекції із точки K на осі X і Y;
Вимірюємо відстань у міліметрах від відповідних проекцій до xmin і ymin: lx = 48,5 мм і ly = 52,5 мм;
Знаючи масштаб осей (mx і my) знаходимо координати точки: x = xmin + lxmx і y = ymin + lymy:
x (1/T) = 2,6810-3 + 48,52,210-6 = 2,78710-3 K-1,
y (Ln(P)) = 10,070 + 52,5*0,01506 = 10,86065.
Приклад 2.1. Необхідно визначити інтегральну теплоту розчинення KCl у воді. Маса наважки mKCl =3,85 г. Стала калориметра К = 1500 Дж/К. Зміна температури в ході термохімічного досліду (реєструється за допомогою термометра Бекмана або електронного калориметра) представлена на рис. 6.
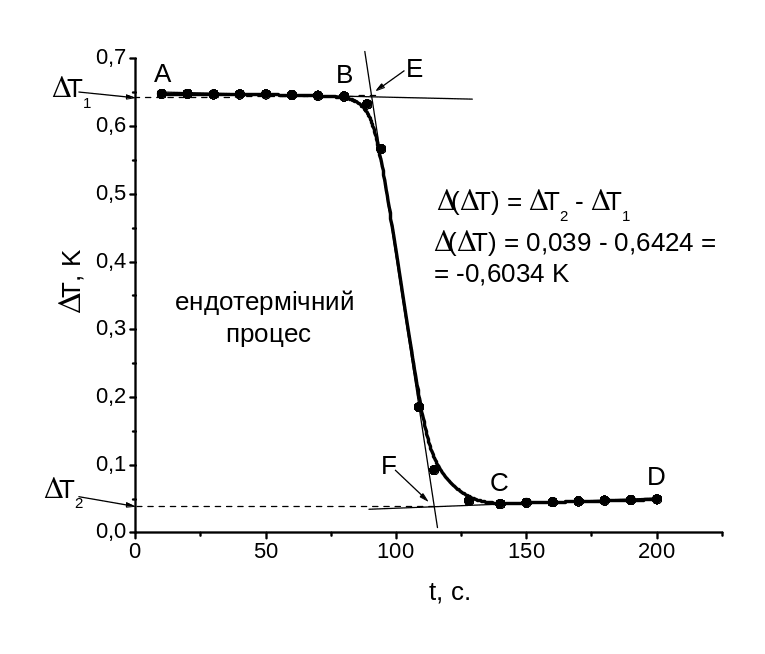
Рис. 6. Термохімічна крива розчинення наважки KCl у воді.
Калориметричні (термохімічні) вимірювання дозволяють експериментально визначати теплові ефекти різних фізико-хімічних процесів, а також теплоємності досліджуваних систем.
Більшість калориметричних вимірювань зводиться до того, що процес, тепловий ефект якого необхідно виміряти, проводять у спеціальному приладі – калориметрі й спостерігають викликану цим процесом зміну температури (Т). Теплові ефекти зв'язуються зі зміною температури рівнянням теплового балансу:
Qp = (m1C1+m2C2+m3C3+……+mnCn)Т, (12)
де m та С – маса та теплоємність досліджуваної системи й усіх частин калориметра, котрі беруть участь в теплообміні. Якщо в ході експерименту величини m і C не змінюються в межах точності експерименту, то рівняння (12) можна записати в наступному виді:
Qp = КТ (13)
де К – стала калориметра, тобто кількість теплоти, котру необхідно надати досліджуваній системі й всім частинам калориметра для нагрівання їх на один градус.
Тепловий ефект визначають за наступним співвідношенням
![]() (14)
(14)
де – кількість речовини, котра бере участь у вивчаємому процесі, моль.
Сталу калориметра визначають, надаваючи калориметру та вивчаємій системі задану кількість тепла (Q) і вимірюючи при цьому зміну температури (Т). Кількість теплоти задається за допомогою електричного нагрівача відомої потужності, або здійснюючи фізико-хімічний процес, тепловий ефект якого відомий, наприклад, розчиняючи у воді наважку KCl:
K = Nt/Т (15)
K= - H/Т (16)
де N – потужність електричного нагрівача; t – час, протягом якого працював нагрівач; – кількість речовини, яка бере участь в процесі, тепловий ефект якого H.
Величину зміни температури (стрибка температури Т) у ході проведення експерименту звичайно визначають графічним шляхом. Для цього експериментальні дані представляються у вигляді графіка, загальний вид якого представлений на рис. 6. Через нанесені експериментальні точки проводиться крива, що згладжує помилки експерименту. Отриману криву можна розділити на три області: ділянка AB – початковий, BC – головний, CD – кінцевий періоди. У момент часу, що відповідає точці B, починається термохімічний дослід, який завершується до моменту часу С. Початковий і кінцевий періоди характеризуються лінійною зміною температури в часі.
Для визначення величини стрибка температури проводять прямі через початковий і кінцевий періоди, а також через лінійну ділянку головного періоду (Рис. 6). Із точок перетинання E і F опускають проекції на вісь ординат, і знаходять величину Т = T2 – T1 .
За графіком визначаємо величину стрибка температури Т = T2 – T1 = 0,039 - 0,6424 = -0,6034 K. Процес є ендотермічним, тому що Т < 0. Знаючи сталу калориметра К розраховуємо кількість теплоти, що поглинулося при розчиненні наважки солі масою 3,85 г:
Q = KТ = 1500 Дж/К (-0,603 K) = -905,1 Дж.
Зная масу наважки солі визначаємо інтегральну теплоту розчинення KCl:
H = -QMKCl/mKCl = -(-905,1 Дж 74,5 г/моль)/3,85 г = 17514 Дж/моль.
Приклад 2.2. Визначите інтегральну теплоту розчинення та гідратоутворення солі CuSO4 та CuSO4·5H2O. Зміну температури в ході термохімічного досліда представлено на рис. 7 – 9.
|
|
|
|
|---|---|---|---|
|
Рис. 7. Термохімічна крива розчинення наважки KCl у воді. |
|
|
|
|
||
Рис. 8. Термохімічна крива розчинення наважки CuSO4 в воде. |
Рис. 9. Термохімічна крива розчинення наважки CuSO4·5H2O в воді. |
||
Теплоту гідратоутворення сульфату міді розраховують за теплотами розчинення безводної солі й кристалогідрату у воді у відповідності із законом Гесса. Схематично процес розчинення безводної солі може бути представлений наступною схемою:
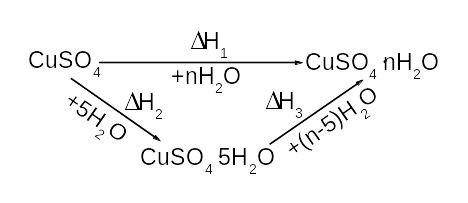
Згідно закону Гесса:
H1 = H2 + H3 (17)
Звідси теплота гідратоутворення CuSO4 дорівнює:
H2 = H1 - H3, (18)
де H1 – теплота розчинення безводної солі CuSO4;
H2 – теплота гідратоутворення;
H3 – теплота розчинення кристалогідрата CuSO4·5H2O.
Теплоти розчинення безводної солі та кристалогідрата визначають експериментально калориметричним методом.
Обробка даних калориметричних вимірювань проводиться за рівнянням теплового балансу:
![]() (19)
(19)
де Hмол – молярна інтегральна теплота розчинення солі, Дж/моль;
G – маса води, г;
g – маса наважки солі, г;
С = 4,103 Дж/г·К питома теплоємністьсть розчину;
Т – стрибок температури в процесі розчинення наважки солі, К;
М – молекулярна маса солі, г.;
К' – стала калориметра, Дж/К.
В рівнянні (19) стала калориметра К' представляє теплоємність усіх частин калориметра, котра не враховує теплоємність реакційного середовища. Якщо порівняти вирази (14) та (19), то К = (G + g)C + K'.
Робота складається із трьох експериментальних й розрахункової частини:
визначення сталої калориметра по розчиненню наважки KCl;
визначення теплоти розчинення безводної солі CuSO4 (H1);
визначення теплоти розчинення кристалогідрата CuSO4·5H2O (H3);
розрахунок теплоти гідратоутворення солі.
Стала калориметра визначається по зниженню температури при розчиненні наважки KCl у воді. Хлорид калію не утворює кристалогідратів, що підвищує точність визначення сталої калориметра. Інтегральна теплота розчинення KCl у воді залежить від концентрації розчину, що утворюється. Її знаходять за довідковими даними методом графічної або чисельної інтерполяції, виходячи з маси наважки KCl і води (див. розділ 6).
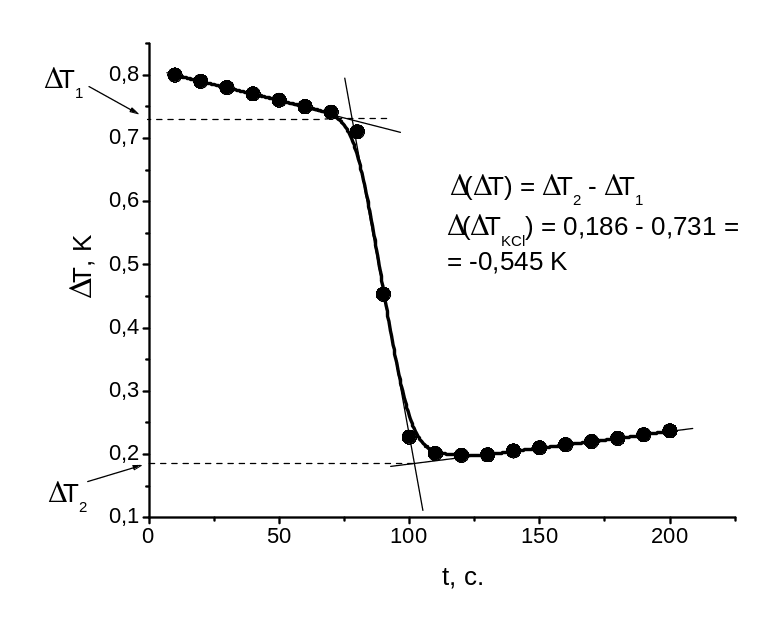
На рис. 7 наведена термохімічна крива розчинення наважки KCl (gKCl = 3,14 г) у воді (G = 300 г). При цьому стрибок температури склав ТKCl = -0,545 К. Хід кривої вказує на ендотермічний характер процеса розчинення хлорида калію в воді.
В довіднику фізико-хімічних величин [10] теплота розчинення солі наведена в залежності від моляльної концентрації утворених розчинів. Розрахуємо моляльну концентрацію розчину KCl, що утворюється:
![]() ,
,
![]()
Методом чисельної інтерполяції довідкових величин знаходимо теплоту розчинення хлорида калію НKCl = 17,56 кДж/моль.
Обчислюємо за рівнянням теплового баланса (19) сталу калориметра К'
![]() ,
,
![]() .
.
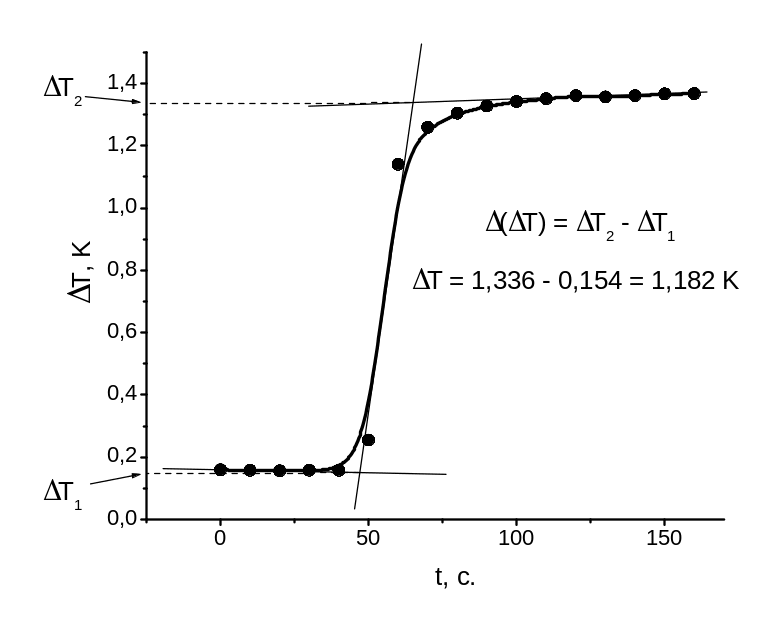
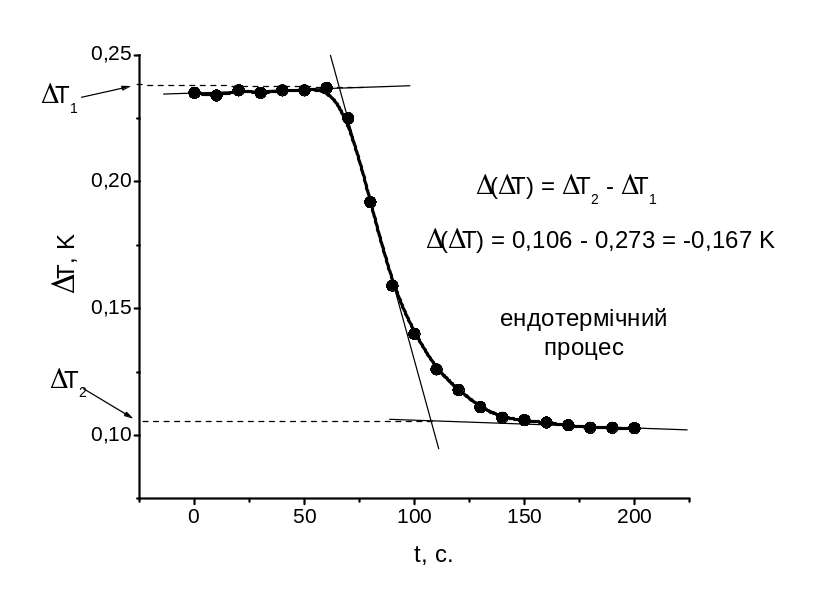
Термохімічні вимірювання розчинення наважок солей CuSO4 (g = 4,2 г) і CuSO4·5H2O (g = 3,3 г) наведені на рисунках 3 та 4. За термохімічними кривими визначаються стрибки температур Δ(ТCuSO4) = 1,182 K та Δ(ТCuSO4 x 5H2O) = -0,167 K.
За рівнянням (19) знайдемо інтегральну теплоту розчинення безводної солі CuSO4 (H1): H1 = -63418 Дж/моль. Визначимо інтегральну теплоту розчинення кристалогідрата CuSO4·5H2O (H3): H3 = 11246 Дж/моль. За соотношениям (18) розрахуємо теплоту гідратутворення CuSO4 (H2):
H2 = -63418 Дж/моль - 11246 Дж/моль = -74664 Дж/моль.

 Рис.
1а. Невірно обраний масштаб осей.
Рис.
1а. Невірно обраний масштаб осей. Рис.
1б. Вірно обраний масштаб осей.
Рис.
1б. Вірно обраний масштаб осей.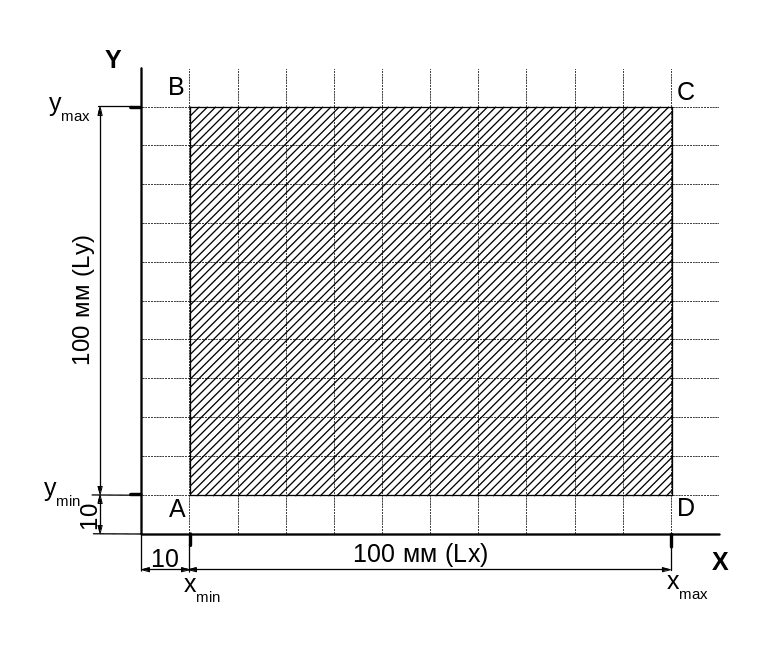 Рис.
2.
Рис.
2.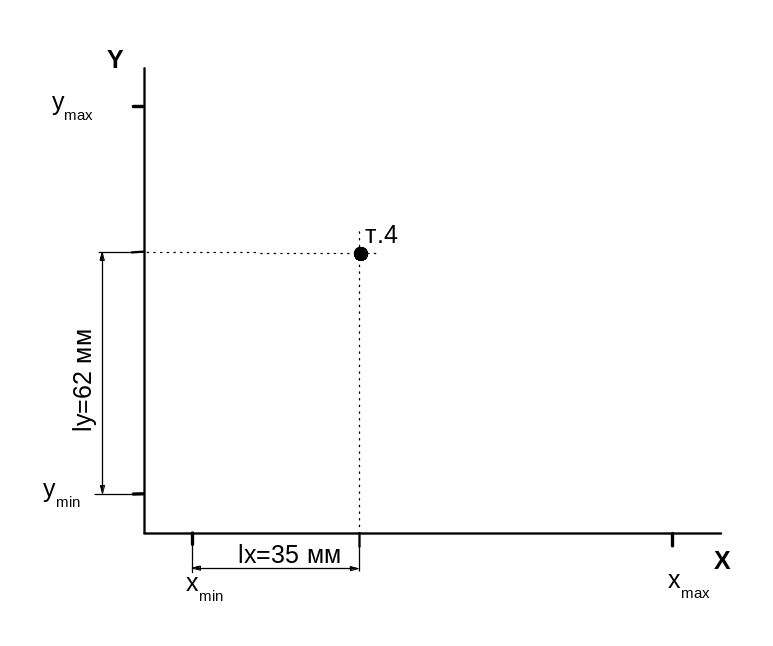
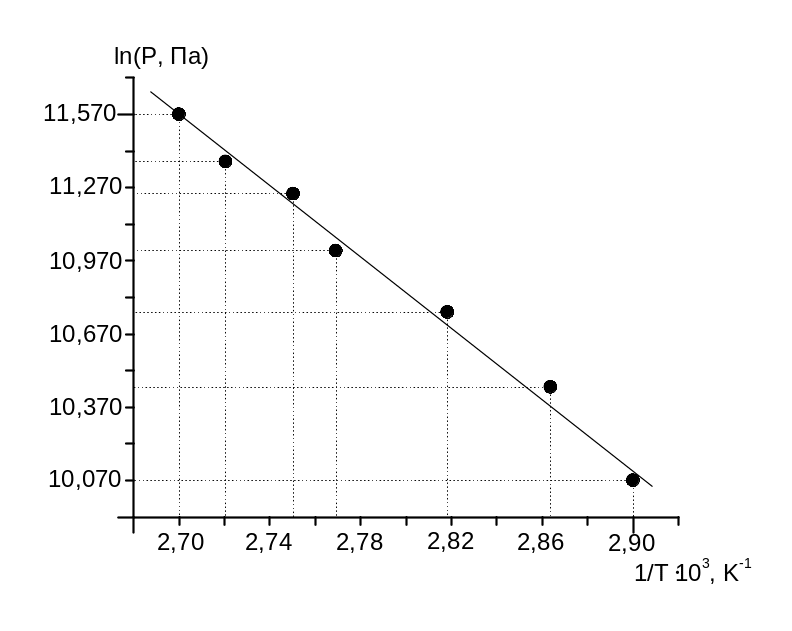 Рис.
4.
Рис.
4. Рис.5.
Рис.5.