
- •Технічний аналіз, стандартизація і сертифікація неорганічних речовин
- •3 Аналіз неорганічних речовин методом 42
- •4 Аналіз неорганічних речовин методом 48
- •Охорона праці та техніка безпеки в хімічних лабораторіях
- •Основні вимоги техніки безпеки під час виконання лабораторних робіт
- •1Аналіз неорганічних речовин методом кислотно-основного титрування
- •1.1Визначення концентрації розчинів кислот та лугів
- •1.2Аналіз аміачної води методом зворотного титрування
- •1.6 Визначення вмісту фосфорної та сульфатної кислот у їх суміші
- •2Аналіз неорганічних речовин методом комплексонометричного титрування
- •3Аналіз неорганічних речовин методом титрування осадження
- •Стислі теоретичні відомості
- •4Аналіз неорганічних речовин методом окислення-відновлення
- •Стислі теоретичні відомості
- •4.1 Аналіз сульфурвмісної руди на вміст сірки йодометричним методом
- •4.2 Визначення купруму у мідному купоросі
- •4.3 Аналіз суміші сульфіду, сульфату та тіосульфату натрію
- •5Потенціометричний аналіз у хтнр
- •Стислі теоретичні відомості
- •5.1 Пряма потенціометрія (йонометрія)
- •5.1.1 Вимірювання рН розчину лугу за допомогою Іонометру ев-74
- •5.2 Потенціометричне титрування однокомпонентних розчинів
- •5.3 Визначення фторидів з використанням фтор-селективного електрода
- •5.4 Визначення нітрату методом добавок
- •6Оптичні методи у хтнр
- •Стислі теоретичні відомості
- •6.1 Визначення показника заломлення
- •6.2 Колориметрія та фотометрія в аналізі неорганічних речовин
- •6.3 Візуальний аналіз
- •6.5 Мікроскопія
- •7Аналіз газових сумішей
- •Стислі теоретичні відомості
- •7.1 Газоволюметрія
- •7.2 Аналіз so2 в газовій суміші
- •7.3 Визначення вмісту компонентів газової суміші. Метод поглинання та спалювання
- •7.4 Визначення вмісту аміаку та оксидів азоту в апс. Метод евакуйованих колб
- •8Аналіз нафтопродуктів
- •Стислі теоретичні відомості
- •8.1 Визначення температури спалаху і займання у відкритому приладі
- •8.2 Визначення температури спалаху в закритому приладі
- •8.3 Визначення в’язкості нафтопродуктів
- •8.4 Визначення вмісту механічних домішок
- •9Гравіметричний аналіз неорганічних речовин
- •Стислі теоретичні відомості
- •9.1 Визначення вмісту кристалізаційної води в хлориді барію
- •9.2 Визначення гігроскопічної води
- •9. 3 Визначення вмісту заліза в солі Мора
- •9.4 Визначення кальцію в карбонатах
2Аналіз неорганічних речовин методом комплексонометричного титрування
Мета роботи: ознайомитися з теоретичними основами методу комплексонометричного титрування, вивчити основні різновиди методу, що застосовуються в хімічній технології неорганічних речовин, провести хімічний аналіз досліджуваних сполук із застосуванням даного методу , виконати необхідні розрахунки та зробити висновки.
Стислі теоретичні відомості
У хімічному аналізі широке застосування знайшла група органічних речовин, які представляють собою похідні імінодіоцтової кислоти. Ці речовини об’єднують спільною назвою «комплексони».
Найбільш вивченим є метод застосування етилендіамінтетраоцтової кислоти (загальновживане скорочення ЕДТА). Вільна кислота малорозчинна у воді, тому застосовують її двозаміщену натрієву сіль – Na2-ЕДТА, трилон Б (звідси іноді термін «трилонометрія»), або комплексон ІІІ:
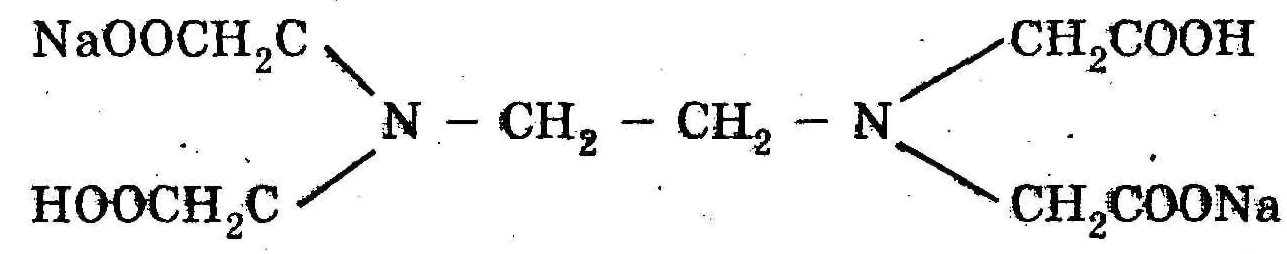
Більшість металів здатні заміщувати атоми водню карбоксильних груп ЕДТА, одночасно об’єднуючись координаційними зв’язками з нітрогеном аміногрупи. Утворюються дуже стійкі комплексні сполуки з кількома п’ятичленними кільцями.
Тривалентні метали замикають ще одне кільце з карбоксильною групою і т.д.
Комплекси ЕДТА з лужноземельними металами (крім берилію), алюмінієм, залізом, цинком, міддю, рідкісноземельними металами, цирконієм і багатьма іншими елементами дуже стійкі. Важливо також, що з найрізноманітнішими металами в різних умовах утворюються завжди комплекси строго певного складу, а саме такі, де відношення металу до ліганду дорівнює 1:1. Це дуже відрізняє ЕДТА від більшості інших комплексоутворювачів для металів. У результаті, застосування ЕДТА розвинулося в окрему групу методів об’ємного аналізу.
2.1 Визначення кальцію в його сполуках у перерахунку на оксидну форму
Кальцій належить до ряду найважливіших елементів, що містяться у в’яжучих матеріалах: вапняку, крейді, доломіті, мармурі, гіпсі, негашеному та гашеному вапні, клінкері, цементі, силікатній цеглі та різноманітних кальцієвих силікатах. Визначення кальцію та його сполук (найчастіше за все оксидів) у досліджуваних матеріалах можна проводити різними методами: гравіметричним, титриметричним (кислотно-основним, перманганатометричним та ін.). Гравіметричним методом осадження ведуть у вигляді оксалату CaC2O4 H2O та ін., але це визначення, як відомо, являє собою досить тривалий процес. Перевагою титриметричних способів визначення кальцію є більш швидке завершення аналізу порівняно з гравіметричним визначенням. Аналіз перманганатометричним методом проводиться тільки непрямим шляхом: методами зворотного титрування або заміщення, що базуються на осадженні катіонів кальцію у вигляді оксалату та подальшому титруванні оксалат-йонів перманганатом калію. При цьому неможливе повне кількісне осадження та відокремлення оксалату кальцію, а звідси, і точне отримання результатів аналізу. Тому, завдяки точності та швидкості виконання, комплексонометричний метод набув широкого застосування у визначенні кальцію та його сполук.
Визначення кальцію в цементі, клінкері, вапняку, доломіті, магнезиті та інших матеріалах, що містять значну кількість полуторних (Fe2O3, Al2O3) оксидів, ведуть з досліджуваного розчину тільки після відокремлення Fe3+ та Al3+.
Проте, існують методики виконання аналізу на вміст кальцію в кальциті, технічному карбонаті кальцію, гашеному та негашеному вапні з незначним вмістом домішок заліза та алюмінію (сліди) без їх відокремлення. Кальцит, карбонат кальцію, гашене та негашене вапно нерозчинні у воді, але розчиняються в хлороводневій кислоті, наприклад:
![]()
За відсутності в лабораторії середніх проб цих матеріалів, можна вести аналіз будь-якої розчинної у воді солі кальцію, наприклад CaCl2 та Ca(NO3)2. Методика виконання аналізу цих солей не відрізняється від аналізу кальциту, крейди тощо, за виключенням того, що відпадає необхідність розчинення наважки у хлороводневій кислоті, її одразу переносять до мірної колби, тим самим скорочується час виконання аналізу, розчин доводять дистильованою водою до мітки, перемішують і аліквотні частини титрують комплексоном ІІІ за реакцією:
![]()
Слід пам’ятати, що стійкість внутрішньокомплексної солі, утвореної катіонами кальцію з комплексоном ІІІ, залежить від рН розчину, тому титрування солей кальцію треба проводити при рН12 (в присутності амонійної буферної суміші та розчину лугу КОН або NaOH). Тільки в цьому випадку досягається повна нейтралізація вільної кислоти, що утворюється, і реакція буде незворотньою.
Матеріали та обладнання:
Розчин НСІ, 2 моль/дм3;
Розчин комплексону ІІІ, 0,05 М;
Розчин NaOH або KOH, 20 %-вий;
Амонійна буферна суміш;
Індикатор: мурексид (суха суміш з NaCl або KCl (1:100));
Піпетки, мірні колби, конічні колби, бюретка, бюкс, лійка;
Аналітичні терези.
Порядок виконання аналізу:
Отримати у викладача зразок речовини для аналізу.
Розрахувати наважку і зважити її на аналітичних терезах (масу записати з чотирма знаками після коми).
Кількісно перенести наважку до термостійкої склянки, додавши 10÷15 см3 розчину НCl.
Закрити склянку годинниковим склом, або фарфоровою чашкою, та нагрівати на водяній бані, або через азбестову сітку на невеликому полум’ї пальника до повного розчинення наважки та видалення бульбашок газу СО2.
Охолодити розчин та кількісно перенести до мірної колби, довести до мітки дистильованою водою та ретельно перемішати.
Відібрати аліквоту отриманого розчину до конічної колби, додати 10 см3 амонійної буферної суміші, 5 см3 20%-го розчину лугу та, на кінчику шпателя, сухої суміші індикатора.
Ретельно перемішати вміст колби, спостерігаючи за появою забарвлення.
Титрувати розчином комплексону ІІІ, ретельно перемішуючи, до появи синьо-фіалкового забарвлення, що переходить у синє від однієї краплі комплексону ІІІ.
Повторити п. п. 6 – 8 мінімум три рази.
Обчислити середній об’єм розчину комплексону ІІІ, що пішов на титрування, і розрахувати масову частку кальцію у перерахунку на оксид кальцію СаО.
Зробити висновки.
2.2 Визначення металів у неорганічних речовинах
2.2.1 Визначення магнію
Константи стійкості етилендиамінтетраацетатів кальція та магнія відрізняються на 2 порядки. Тому ці йони не можна від титрувати окремо, використовуючи лише різницю в константах стійкості комплексонатів. При рН ~ 10 в якості метало індикаторів використовують еріохром чорний Т. За таких умов визначають суму кальцію та магнію. В іншій аліквот ній частині створюють рН > 12, при цьому магній осаджується у вигляді гідроксиду, а в розчині залишається комплексонометричний кальцій, який титрується в присутності мурексиду. Магній визначається за різницею.
Матеріали та обладнання:
Стандартний розчин ЕДТА, 0,050 моль/дм3;
Аміачна буферна суміш з рН 10;
Індикатор: еріохромовий чорний Т, мурексид (суміш з NaCl 1:100);
Піпетки, мірні колби, конічні колби, бюретка, бюкс, лійка;
Аналітичні терези.
Порядок виконання аналізу:
1. Отримати у викладача розчин для аналізу.
2. Для визначення суми кальцію та магнію слід відібрати піпеткою 10 см3 досліджуваного розчину в конічну колбу для титрування, додати 2÷3 см3 буферної суміші, 15 см3 дистильованої води, на кінчику шпателя 20-30 мг індикаторної суміші еріохрому чорного Т. Як тільки порошкоподібний індикатор розчиниться, відтитрувати досліджуваний зразок розчином ЕДТА до зміни забарвлення з винно-червоного на блакитне.
3. Для визначення кальцію відібрати піпеткою 10 см3 досліджуваного розчину в конічну колбу для титрування, додати 2÷3 см3 розчину гідроксиду натрію або калію, розбавити дистильованою водою до 25 см3, після чого внести до розчину на кінчику шпателя 20-30 мг індикаторної суміші мурексиду. Як тільки порошкоподібний індикатор розчиниться, відтитрувати досліджуваний зразок розчином ЕДТА до зміни забарвлення з рожевого на фіолетове.
4. Зафіксувати об’єм ЕДТА, що пішов на титрування в обох випадках.
5. Повторити п. п. 2 – 4 мінімум три рази.
6. Об’єм титранту, витраченого на титрування магнію, визначити за різницею об’єму ЕДТА, що пішов на титрування при рН 10 та при рН 12.
7. Розрахувати концентрацію кальцію та магнію у досліджуваних зразках, зробити висновки.
2.2.2 Визначення міді
Йони міді утворюють з ЕДТА комплекси блакитного кольору з константою стійкості 6,3·1018. Умови прямого титрування міді визначаються обраним металоіндикатором. В присутності мурексиду, який утворює з міддю комплекс зеленувато-жовтого кольору, титрування можна проводити при рН 6 (умовна константа стійкості комплексонату міді при рН 6 рівна 1,4·1014).
Матеріали та обладнання:
Стандартний розчин ЕДТА, 0,050 моль/дм3;
Ацетатна буферна суміш з рН 6;
Індикатор: мурексид (суха суміш з NaCl або KCl (1:100));
Піпетки, мірні колби, конічні колби, бюретка, бюкс, лійка;
Аналітичні терези.
Порядок виконання аналізу:
1. Отримати у викладача розчин (зразок порошку) для аналізу.
2. Приготувати розчин для аналізу з концентрацією в межах С(Сu2+) = 1÷2 г/дм3.
3. Після перемішування відібрати піпеткою 10 см3 розчину в конічну колбу для титрування, додати 20 см3 дистильованої води, 5 см3 буферної суміші, на кінчику шпателя 20-30 мг індикаторної суміші.
4. Як тільки порошкоподібний індикатор розчиниться, від титрувати досліджуваний зразок розчином ЕДТА до зміни забарвлення на фіолетове.
5. Зафіксувати об’єм ЕДТА, що пішов на титрування, та додати 1-2 см3 ацетатного буферного розчину. Якщо колір розчину не змінився, титрування слід припинити. У випадку, коли після додавання буферу розчин набуває жовтого, або жовтувато-зеленого кольору, титрування продовжують до отримання стійкого фіолетового кольору.
6. Повторити п. п. 3 – 5 мінімум три рази.
7. Розрахувати концентрацію міді у досліджуваних зразках, зробити висновки.
2.2.3 Визначення цинку
Йони цинку утворюють з ЕДТА безбарвний комплекс складу ZnY2- з константою стійкості 3,27·1016. Пряме титрування цинкув присутності еріохромчорного Т проводять за кімнатної температури при рН 6 (умовна константа стійкості рівна 7,0·1011).
Матеріали та обладнання:
Стандартний розчин ЕДТА, 0,050 моль/дм3;
Аміачна буферна суміш;
Індикатор: еріохром чорний Т (суха суміш з NaCl у співвідношенні 1:100);
Піпетки, мірні колби, конічні колби, бюретка, бюкс, лійка;
Аналітичні терези.
Порядок виконання аналізу:
1. Отримати у викладача розчин (зразок порошку) для аналізу.
2. Приготувати розчин для аналізу з концентрацією в межах С(Zn2+) = 1÷1,5 г/дм3.
3. Після перемішування відібрати піпеткою 10 см3 розчину в конічну колбу для титрування, додати 20 см3 дистильованої води, 5 см3 буферної суміші, на кінчику шпателя 20-30 мг індикаторної суміші.
4. Як тільки порошкоподібний індикатор розчиниться, відтитрувати досліджуваний зразок розчином ЕДТА до зміни забарвлення з винно-червоного на блакитне (синє).
5. Зафіксувати об’єм ЕДТА, що пішов на титрування.
6. Повторити п. п. 3 – 5 мінімум три рази.
7. Розрахувати концентрацію міді у досліджуваних зразках, зробити висновки.
Зауваження:
Константи стійкості етилендиамінтетраацетатів міді та цинку близькі за значенням, що не дозволяє окремо титрувати ці елементи, ґрунтуючись на різниці умовних констант стійкості при зміні рН. Для підвищення селективності неможна використовувати і специфічні металоіндикатори, оскільки вони однакові для міді та цинку. Тіосульфат натрію маскує вибірково мідь (ІІ), відновлюючи її до міді (І) і утворюючи стійкий розчинний комплекс. Етилендиамінтетраацетат міді (І) нестійкий. Метод окремого комплексонометричного титрування ґрунтується на визначення суми міді та цинку при рН 6 в присутності індикатору 4-(2-піриділазо)резорцину (ПАР) і на визначенні одного лише цинку в присутності ПАР в окремій порції розчину після маскування міді тіосульфатом.
2.2.4 Визначення заліза
В сильно кислому середовищі при рН < 0,9, комплекси заліза (ІІІ) з ЕДТА утворюються відповідно до рівняння:
![]()
При рН > 1,3 переважає комплекс FeY- з константою стійкості 1,3·1025.
Комплексонат заліза (ІІ) значно меншстійкий (константа стійкості за тих же умов 2,0·1014) та вкрай нестійкий по відношенню до окисників. Навіть киснем повітря він окислюється до комплексонату заліза (ІІІ), тому комплексонометрично можна визначити лише залізо (ІІІ).
В якості металоіндикаторів використовують тайрон, саліцилову або сульфосаліцилову кислоти. Ці індикатори в розчинах безбарвні, але здатні утворювати з залізом (ІІІ) інтенсивно забарвлені комплекси: червоного кольору з тайроном, фіолетового кольору з саліциловою або сульфосаліциловою кислотами.
Матеріали та обладнання:
Стандартний розчин ЕДТА, 0,050 моль/дм3;
Хлороводнева кислота конц. (ρ = 1,17 г/см3), 1М та 2М розчини;
Нітратна кислота конц. (ρ = 1,4 г/см3);
Аміак, 10%-вий розчин.
Індикатор: сульфосаліцилова кислота (25%-вий водний розчин);
Піпетки, мірні колби, конічні колби, бюретка, лійка;
Аналітичні терези.
Порядок виконання аналізу:
1. Отримати у викладача розчин (зразок порошку) для аналізу.
2. Приготувати розчин для аналізу з концентрацією в межах С(Fe2O3) = 1÷2 г/дм3.
3. Після перемішування відібрати піпеткою 10 см3 розчину в конічну колбу для титрування, додати 5 см3 концентрованої НСІ та 2 см3 концентрованої НNO3 для окиснення заліза (ІІ), накрити колбу годинниковим склом, помістити на піщану баню та нагрівати, не допускаючи бурхливого кипіння, 3-5 хвилин до появи оранжево-жовтого забарвлення розчину.
4. Знявши колбу з бані, слід змити над колбою годинникове скло водою та охолодити її вміст під струменем водопровідної води. Обережно нейтралізувати розчином аміаку за індикатором конго до бурого кольору паперу. Розчин можна нейтралізувати аміаком без індикатору, вводячи аміак по краплинах до зміни забарвлення з лимонно-жовтої на жовту (з’являється слабке незникаюче помутніння). Після чого додати 1÷2 краплини 2М розчину НСІ, 1 см3 1М розчину НСІ, розбавити дистильованою водою до 50 см3 та нагріти майже до кипіння.
5. До гарячого розчину додати 4÷5 крапель розчину сульфосаліцилової кислоти та від титрувати розчином ЕДТА до зміни забарвлення з фіолетового на лимонно-жовте. Поблизу точки еквівалентності розчин ЕДТА слід додавати повільно, слідкуючи щоб розчин протягом всього титрування залишався гарячим.
6. Повторити п. п. 3 – 5 мінімум три рази.
7. Розрахувати концентрацію міді у досліджуваних зразках, зробити висновки.
