
- •60.Коллоидные р-ры (золи). Механизм образования мицеллы при взаимодействии электролитов в водной среде. Строение мицеллы. Устойчивость и коагуляция золей.
- •61.Основные классы неорганических соединений
- •62. Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных
- •63 Основания (кислотность оснований). Методы получения, хим. Св-ва, номенклатура.
- •64. Кислоты (основность кислот). Методы получения, хим. Св-ва, номенклатура.
- •65 Соли, типы солей. Методы получения, химические св-ва, номенклатура средних, кислых, основных солей.
- •66.Комплексные соединения, их структура
- •68.Устойчивость комплексных соединений. Константа нестойкости
- •69. Квантово-механическая модель атома: уравнение де Бройля и Шредингера, принцип неопределённости Гейзенберга, атомная орбиталь, квантовые числа.
- •70. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •71.Строение атомных ядер. Изотопы
- •72. Периодический закон Менделеева. Периодическая таблица (периоды и группы).
- •73.Потенциал ионизации, сродство к электрону, электроотрицательность элементов; характер изменения по группам и периодам Периодической системы элементов.
- •76.Ионная, , металлическая, водородная связь.
- •79.Межмолекулярные взаимодействия (дисперсионное, ориентационное, индукционное).
72. Периодический закон Менделеева. Периодическая таблица (периоды и группы).
Периодический закон (1869 г.): свойства простых тел, а также свойства и формы соединений элементов находятся в периодической зависимости от величины атомных весов элементов. До появления сведений о сложном строении атома основной характеристикой элемента служил атомный вес (относительная атомная масса). Развитие теории строения атома привело к установлению того факта, что главной характеристикой атома является положительный заряд ядра.
В современной формулировке периодический закон звучит: свойства химических элементов, а также формулы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Физической основой структуры периодической системы элементов служит определённая последовательность формирования электронных конфигураций атомов по мере роста порядкового номера элемента.
В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают 4 типа элементов:
S – элементы (последним заполняется S -подуровень внешнего энергетического уровня)
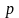 – элементы
(последним заполняется
-подуровень
– элементы
(последним заполняется
-подуровень
2. p – элементы (последним заполняется p -подуровень внешнего энергетического уровня)
3. d – элементы (последним заполняется d -подуровень предпоследнего энергетического уровня)
4. f – элементы (последним заполняется f -подуровень 3-го снаружи энергетического уровня).
Горизонтально
располагаются периоды
– последовательный ряд элементов,
электронная конфигурация внешнего
энергетического уровня которых изменяется
от
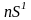 до
до
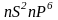 .
Номер периода совпадает со значением
главного квантового числа
внешнего энергетического уровня.
.
Номер периода совпадает со значением
главного квантового числа
внешнего энергетического уровня.
Вертикально
располагаются группы
– элементы имеющие сходное электронное
строение. У элементов главной
подгруппы
последним заполняется
и
подуровни внешнего энергетического
уровня, у элементов побочной
подгруппы
происходит заполнение внутренних
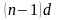 и
и
 подуровней. Одинаковый номер группы,
как правило, определяет число электронов,
которое может участвовать в образовании
химических связей.
подуровней. Одинаковый номер группы,
как правило, определяет число электронов,
которое может участвовать в образовании
химических связей.
73.Потенциал ионизации, сродство к электрону, электроотрицательность элементов; характер изменения по группам и периодам Периодической системы элементов.
ПОТЕНЦИАЛ ИОНИЗАЦИИ частицы (молекулы, атома, иона), минимальная разность потенциалов U, к-рую должен пройти электрон в ускоряющем электрич. поле, чтобы приобрести кинетич. энергию, достаточную для ионизации частицы. П. и. частицы X с образованием частицы X соответствует процессу:
X + е : X + 2е.
Более общее понятие-энергия ионизации Е, миним. энергия, необходимая для удаления электрона из частицы на бесконечность. Она связана с П. и. соотношением:
E=Ue,
где е- элементарный электрич. заряд. Энергия ионизации является св-вом частицы и не зависит от способа удаления электрона, тогда как П. и., строго говоря, лишь характеристика исторически первого метода ионизации электронным ударом. Энергия ионизации, выраженная в эВ, численно совпадает с П. и., выраженным в В.
П. и. вместе со сродством к электрону определяет величину электроотрицательности атомов и молекул. Знание П. и. необходимо для расчетов термохим. процессов в иони-зир. газах и плазме
Сродство к электрону, электронное сродство, способность некоторых нейтральных атомов, молекул и радикалов свободных присоединять добавочные электроны, превращаясь в отрицательные ионы.
74-75. Образование ковалентной химической связи (метод валентных связей).Обменный механизм образования ковалентной связи (сигма-связь, пи-связь). Донорно-акцепторная связь.
Для объяснения ковалентной связи используют 2 метода квантово-механического расчета:
1.метод валентных связей (МВС)
2.метод молекулярных орбиталей (ММО)
Согласно методу
валентных связей
ковалентная связь образуется не путем
передачи, а путем обобществления
неспаренных электронов с антипараллельными
спинами по 1-му от каждого атома.
Образовавшаяся в этом случае электронная
пара принадлежит обоим атомам.
 Сl
– Cl
– обозначение ковалентной связи.
Сl
– Cl
– обозначение ковалентной связи.
Чем в большей степени перекрываются атомные орбитали, тем прочнее связь.
Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве.
Ковалентная связь в отличие от ионной имеет направленность. Атомные орбитали могут перекрываться двумя способами:
1-ый способ: перекрывание в направлении главных осей (осей, связывающих ядра).
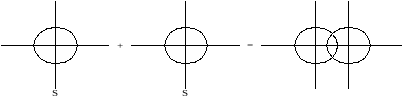
Образовавшаяся при этом перекрывании ковалентная связь называется -сигма связь.
2-ой способ: P-орбитали с параллельными осями.
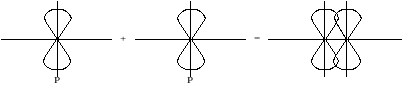
Боковое перекрывание образует -связь, менее прочную связь чем - сигма. В соответствии с правилом Паули между двумя атомами может быть либо 1-сигма связь, либо 1-сигма и 1-связь, либо 1-сигма и 2-связи.
