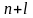- •60.Коллоидные р-ры (золи). Механизм образования мицеллы при взаимодействии электролитов в водной среде. Строение мицеллы. Устойчивость и коагуляция золей.
- •61.Основные классы неорганических соединений
- •62. Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных
- •63 Основания (кислотность оснований). Методы получения, хим. Св-ва, номенклатура.
- •64. Кислоты (основность кислот). Методы получения, хим. Св-ва, номенклатура.
- •65 Соли, типы солей. Методы получения, химические св-ва, номенклатура средних, кислых, основных солей.
- •66.Комплексные соединения, их структура
- •68.Устойчивость комплексных соединений. Константа нестойкости
- •69. Квантово-механическая модель атома: уравнение де Бройля и Шредингера, принцип неопределённости Гейзенберга, атомная орбиталь, квантовые числа.
- •70. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •71.Строение атомных ядер. Изотопы
- •72. Периодический закон Менделеева. Периодическая таблица (периоды и группы).
- •73.Потенциал ионизации, сродство к электрону, электроотрицательность элементов; характер изменения по группам и периодам Периодической системы элементов.
- •76.Ионная, , металлическая, водородная связь.
- •79.Межмолекулярные взаимодействия (дисперсионное, ориентационное, индукционное).
70. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
1.Принцип устойчивости (принцип min энергии): Каждая новая орбиталь заполняется только после того, как будут заполнены все предыдущие, т.е. более устойчивые (с min энергией) орбитали.
Энергия атомных орбиталей возрастает следующим образом:
|
|
|
Орбиталь |
1 |
0 |
1 |
1s |
2 |
0 |
2 |
2s |
1 |
3 |
2p |
|
3 |
0 |
3 |
3s |
1 |
4 |
3p |
|
2 |
5 |
3d |
|
4 |
0 |
4 |
4s |
1 |
5 |
4p |
|
2 |
6 |
4d |
|
3 |
7 |
4f |
|
555 5 |
0 |
5 |
5s |
1 |
6 |
5p |
|
2 |
7 |
5d |
|
3 |
8 |
5f |
|
4 |
9 |
5g |
|
|
|||
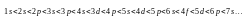
Правило Клечковского: заполнение электронами атомных орбиталей происходит в соответствии с увеличением суммы главного и побочного квантовых чисел; если одинакова, то атомная орбиталь заполняется от больших и меньших к меньшим и большим .
2.Принцип Паули:
в атоме не может быть 2 электрона, у
которых 4 одинаковых квантовых числа.
Следовательно, на 1-ой орбитали могут
находиться не более 2-х электронов,
отличающихся друг от друга значением
спинового квантового числа. Отсюда
следует, что максимальное количество
электронов на энергетическом уровне
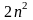 ,
на энергетическом подуровне
,
на энергетическом подуровне
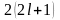 .
.
Пример:
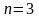
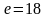
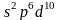
3.Правило Хунда: электроны располагаются на орбиталях равной энергии таким образом, чтобы их суммарный спин был максимальный. Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по 1-му, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми электронами.
Количество неспаренных электронов на внешнем уровне определяет валентность элемента, т.е. способность образовывать химические связи с другими атомами. В большинстве случаев, но не всегда.
71.Строение атомных ядер. Изотопы
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несут положительный заряд.
В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда.
Атом может потерять один или несколько электронов или наоборот – захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Практически вся масса атома сосредоточена в его ядре.
В состав ядра атома водорода входит только 1 протон, а электронное облако заполняется одним электроном.
Масса атома, выраженная в килограммах или граммах, называется абсолютной атомной массой. Чаще пользуются относительной атомной массой, которая выражается в атомных единицах массы (а.е.м.). Относительная атомная масса представляет собой отношение массы какого-нибудь атома к массе 1/12 части атома углерода.
Изотопами называются вещества, состоящие из атомов с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре. Изотопы отличаются друг от друга только массовым числом. Все элементы состоят из одного или нескольких изотопов.