
- •1.1. Волновое уравнение для электромагнитной волны. Основные свойства электромагнитных волн.
- •1.2. Интенсивность электромагнитной волны. Поведение плоской волны на границе раздела сред.
- •2.1. Световая волна. Показатель преломления среды. Законы геометрической оптики.
- •2.2. Оптическая длина пути. Принцип Ферма. Таутохронность.
- •2.3. Формула тонкой линзы, построение изображений в линзах.
- •Принцип суперпозиции волн. Интенсивность при сложении двух волн.
- •Расчет интерференционной картины от двух источников. Ширина полосы и количество наблюдаемых полос.
- •3.3. Способы получения когерентных источников в оптике: бизеркала Френеля, зеркало Ллойда, бипризма Френеля, билинзаБийе.
- •3.5. Интерференция в тонких пленках. Полосы равной толщины и равного наклона. Кольца Ньютона.
- •4.1. Дифракция света. Дифракция Френеля и дифракция Фраунгофера.
- •Принцип Гюйгенса-Френеля. Зоны Френеля.
- •Дифракция Френеля на круглом отверстии и диске.
- •Дифракция Фраунгофера на длинной щели и двух щелях.
- •4.5. Дифракционная решетка
- •5.1 Естественный и поляризованный свет. Типы поляризации. Степень поляризации.
- •5.2Поляризаторы и анализаторы. Прохождение света через совершенные и несовершенные поляризаторы. Закон Малюса.
- •5.3. Поляризация света при отражении. Закон Брюстера.
- •5.4.Прохождение света через анизотропную среду. Одноосные кристаллы. Обыкновенная и необыкновенная волны.
- •Интерференция поляризованных волн.
- •Искусственная анизотропия. Эффект Керра. Вращение плоскости поляризации (оптическая
- •6.1. Поглощение света. Рассеяние света. Дисперсия света
- •6.2. Тепловое излучение, его характеристики и законы.
- •6.3. Квантовая гипотеза Планка, формула Планка.
- •7.5. Неприменимость понятия траектории к микрочастицам. Соотношение неопределенностей Гейзенберга.
- •7.6. Задание состояния частицы в квантовой механике. Волновая функция и ее статистический смысл. Нормировка.
- •7.7.Стационарные состояния. Временное и стационарное уравнение Шредингера.
- •7.8.Частица в одномерной бесконечно глубокой потенциальной яме. Волновые функции и квантование энергии.
- •7.9.Гармонический осциллятор в квантовой механике.
- •7.10. Прохождение частицы через одномерный потенциальный барьер. Туннельный эффект.
- •7.11.Теория Бора для атома водорода. Экспериментальное подтверждение постулатов Бора. Опыт Франка и Герца.
- •7.12. Квантовомеханическая модель атома водорода. Квантовые числа. Энергия, момент импульса и его проекция для электрона в атоме водорода. Спектральные серии атома водорода.
- •7.13. Пространственное квантование. Опыт Штерна-Герлаха. Спин электрона.
- •7.14. Принцип запрета Паули. Периодическая система элементов. Распределение электронов по оболочкам и подоболочкам в атоме.
7.13. Пространственное квантование. Опыт Штерна-Герлаха. Спин электрона.
Модуль
орбитального механического момента
электрона можно определить по формуле
,
где
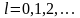 –
орбитальное квантовое число электрона.
Проекция орбитального механического
момента электрона на некоторое направление
Z
согласно формуле определяется выражением
,
где
–
орбитальное квантовое число электрона.
Проекция орбитального механического
момента электрона на некоторое направление
Z
согласно формуле определяется выражением
,
где
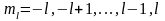 – магнитное квантовое число электрона.
Следовательно, при
– магнитное квантовое число электрона.
Следовательно, при
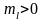 проекция
проекция
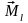 положительна, а при
положительна, а при
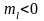 – наоборот. Отметим, что направление Z
в пространстве обычно выделяется внешним
полем (например магнитным или
электрическим), в котором находится
атом. Формулы свидетельствуют о том,
что магнитный момент заряженной
микрочастицы квантуется.
– наоборот. Отметим, что направление Z
в пространстве обычно выделяется внешним
полем (например магнитным или
электрическим), в котором находится
атом. Формулы свидетельствуют о том,
что магнитный момент заряженной
микрочастицы квантуется.
Спин (спиновый момент) – это квантовая величина, не имеющая классического аналога. Он является неотъемлемым свойством электрона и других элементарных частиц подобно тому, как они имеют массу, а заряженные частицы – еще и заряд. Спин характеризует внутреннее свойство квантовой частицы, связанное с наличием у нее дополнительной степени свободы.
Модуль
спина (собственного механического
момента импульса)
 частицы определяется по законам квантовой
теории и должен быть квантован по закону
частицы определяется по законам квантовой
теории и должен быть квантован по закону
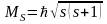 ,
где s
– спиновое квантовое число (часто
называют спином). В отличие от квантовых
чисел l
и m
число s
может быть как целым, так и полуцелым.
,
где s
– спиновое квантовое число (часто
называют спином). В отличие от квантовых
чисел l
и m
число s
может быть как целым, так и полуцелым.
Проекция
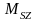 спина
на ось Z
также должна быть квантована:
спина
на ось Z
также должна быть квантована:
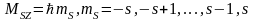 ,
где ms
– магнитное спиновое (называют также
просто спиновым) квантовое число –
число возможных проекций
,
соответствующих данному значению s.
,
где ms
– магнитное спиновое (называют также
просто спиновым) квантовое число –
число возможных проекций
,
соответствующих данному значению s.
В 1922 г. О. Штерн и В. Герлах исследовали прохождение атомов серебра Ag в сильно неоднородном вдоль оси Z магнитном поле сильного электромагнита с полюсными наконечниками специальной формы SN. Они обнаружили, что атомный пучок расщеплялся на два компонента, расположенных симметрично относительно первоначального направления. Это означает, что атомы Ag, у которых один внешний электрон, обладают магнитным моментом, проекции которого на направление Z принимают два значения с противоположными знаками, т. е. магнитный момент квантуется.
7.14. Принцип запрета Паули. Периодическая система элементов. Распределение электронов по оболочкам и подоболочкам в атоме.
Простейший
подход к описанию электронов в атоме
основан на том, что каждый электрон
характеризуется четырьмя квантовыми
числами: 1) главным n (
)
2) орбитальным
(
)
3) магнитным
(
)
4) магнитым спиновым
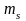 (
(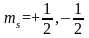 ,
иногда обозначают как
,
иногда обозначают как
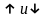 ).
).
Энергия электрона зависит в основном от чисел n и l и изменяется сильнее с увеличением главного квантового числа, чем с увеличением l. Поэтому, как правило, состояние с бόльшим n обладает, независимо от значения l, бoльшей энергией. Если атом находится в невозбужденном состоянии, то все электроны должны располагаться на самых низких доступных для них энергетических уровнях. Объяснение возможных конфигураций электронов в атоме сформулировал В. Паули (Нобелевская премия, 1945 г.).
Принцип Паули (1925): в квантовой системе в одном и том же квантовом состоянии не могут одновременно находиться две тождественные частицы с полуцелым спином.
Следовательно, в сложном атоме в каждом из возможных квантовых состояний может находиться не более одного электрона. Два электрона в одном и том же атоме не могут иметь одинакового набора квантовых чисел n, l, и . Принцип Паули составляет основу понимания не только структуры атомов и молекул, но и природы химической связи и многих других явлений.
Совокупность электронов в многоэлектронном атоме с одинаковыми значениями квантового числа n называется электронной оболочкой. Оболочки подразделяют на подоболочки, отличающиеся квантовым числом l. Количество электронов в подоболочке определяется квантовыми числами и . Максимальное число электронов в подоболочке (число состояний в подоболочке) равно 2(2l +1).
Периодическая система элементов Д.И.Менделеева – фундаментальный закон природы, являющийся основой современной химии, атомной и ядерной физики. Д.И.Менделеев ввел важнейшее понятие порядкового номера Z химического элемента (общее число электронов в электронной оболочке атома).
Теория периодической системы основывается на следующих положениях:
1.) Порядковый номер химического элемента равен общему числу электронов в атоме данного элемента. 2.) Состояние электронов в атоме определяется набором их квантовых чисел n, l, и . Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума полной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией. 3.) Заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
Химические элементы образуют восемь вертикальных столбцов – групп. Группы обозначаются римскими цифрами и соответствует высшей положительной валентности элемента. Горизонтальные ряды называются периодами и обозначаются арабскими цифрами (от 1 до 7). Периоды соответствуют последовательному заполнению электронных оболочек с возрастающими значениями n и l.
