
- •1.1. Волновое уравнение для электромагнитной волны. Основные свойства электромагнитных волн.
- •1.2. Интенсивность электромагнитной волны. Поведение плоской волны на границе раздела сред.
- •2.1. Световая волна. Показатель преломления среды. Законы геометрической оптики.
- •2.2. Оптическая длина пути. Принцип Ферма. Таутохронность.
- •2.3. Формула тонкой линзы, построение изображений в линзах.
- •Принцип суперпозиции волн. Интенсивность при сложении двух волн.
- •Расчет интерференционной картины от двух источников. Ширина полосы и количество наблюдаемых полос.
- •3.3. Способы получения когерентных источников в оптике: бизеркала Френеля, зеркало Ллойда, бипризма Френеля, билинзаБийе.
- •3.5. Интерференция в тонких пленках. Полосы равной толщины и равного наклона. Кольца Ньютона.
- •4.1. Дифракция света. Дифракция Френеля и дифракция Фраунгофера.
- •Принцип Гюйгенса-Френеля. Зоны Френеля.
- •Дифракция Френеля на круглом отверстии и диске.
- •Дифракция Фраунгофера на длинной щели и двух щелях.
- •4.5. Дифракционная решетка
- •5.1 Естественный и поляризованный свет. Типы поляризации. Степень поляризации.
- •5.2Поляризаторы и анализаторы. Прохождение света через совершенные и несовершенные поляризаторы. Закон Малюса.
- •5.3. Поляризация света при отражении. Закон Брюстера.
- •5.4.Прохождение света через анизотропную среду. Одноосные кристаллы. Обыкновенная и необыкновенная волны.
- •Интерференция поляризованных волн.
- •Искусственная анизотропия. Эффект Керра. Вращение плоскости поляризации (оптическая
- •6.1. Поглощение света. Рассеяние света. Дисперсия света
- •6.2. Тепловое излучение, его характеристики и законы.
- •6.3. Квантовая гипотеза Планка, формула Планка.
- •7.5. Неприменимость понятия траектории к микрочастицам. Соотношение неопределенностей Гейзенберга.
- •7.6. Задание состояния частицы в квантовой механике. Волновая функция и ее статистический смысл. Нормировка.
- •7.7.Стационарные состояния. Временное и стационарное уравнение Шредингера.
- •7.8.Частица в одномерной бесконечно глубокой потенциальной яме. Волновые функции и квантование энергии.
- •7.9.Гармонический осциллятор в квантовой механике.
- •7.10. Прохождение частицы через одномерный потенциальный барьер. Туннельный эффект.
- •7.11.Теория Бора для атома водорода. Экспериментальное подтверждение постулатов Бора. Опыт Франка и Герца.
- •7.12. Квантовомеханическая модель атома водорода. Квантовые числа. Энергия, момент импульса и его проекция для электрона в атоме водорода. Спектральные серии атома водорода.
- •7.13. Пространственное квантование. Опыт Штерна-Герлаха. Спин электрона.
- •7.14. Принцип запрета Паули. Периодическая система элементов. Распределение электронов по оболочкам и подоболочкам в атоме.
7.12. Квантовомеханическая модель атома водорода. Квантовые числа. Энергия, момент импульса и его проекция для электрона в атоме водорода. Спектральные серии атома водорода.
Будем
рассматривать водородоподобный атом,
содержащий единственный внешний
электрон. Электрическое поле, создаваемое
ядром, является примером центрального
поля. Поскольку масса ядра водородноподобного
атома во много раз больше массы электрона
(различие для атома водорода составляет
почти 2000 раз), то приближенно можно
считать, что она бесконечно велика и
что ядро все время находится в начале
координат (ядро неподвижно). Тогда задачу
о водородоподобном атоме можно представить
как задачу о движении электрона в
фиксированном поле сил с потенциалом:
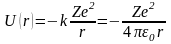 ,
где r-радиальная
переменная - расстояние между электроном
и ядром, Z
- атомное число, e
- абсолютное значение заряда электрона,
потенциал U(r)
описывает кулоновское поле ядра. Движение
электрона в таком поле можно рассматривать
как движение в некоторой сферической
потенциальной яме (обойдется без
рисунка). В этом случае стационарное
уравнение Шредингера имеет вид:
,
где r-радиальная
переменная - расстояние между электроном
и ядром, Z
- атомное число, e
- абсолютное значение заряда электрона,
потенциал U(r)
описывает кулоновское поле ядра. Движение
электрона в таком поле можно рассматривать
как движение в некоторой сферической
потенциальной яме (обойдется без
рисунка). В этом случае стационарное
уравнение Шредингера имеет вид:
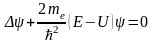 ,
где волновая функция
,
где волновая функция
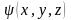 описывает состояние электрона в атоме,
E
- значения полной энергии электрона в
атоме, которые требуется найти при
условии, что
удовлетворяет требованиям конечности,
однозначности и непрерывности (эво как
xD).
описывает состояние электрона в атоме,
E
- значения полной энергии электрона в
атоме, которые требуется найти при
условии, что
удовлетворяет требованиям конечности,
однозначности и непрерывности (эво как
xD).
Формула
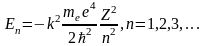 определяет возможные значения энергии
водородоподобного атома. Случай E
> 0
соответствует электрону, оторванному
от атома (свободный электрон). Случай E
< 0
соответствует связанным состояниям
электрона (электрону в атоме).
определяет возможные значения энергии
водородоподобного атома. Случай E
> 0
соответствует электрону, оторванному
от атома (свободный электрон). Случай E
< 0
соответствует связанным состояниям
электрона (электрону в атоме).
Квантовые
числа атома водорода. Стационарные
состояния атома водорода без учета
спина можно охарактеризовать набором
трех квантовых чисел.
Квантовое
число n
из теории Бора сохраняется и в квантовой
механике и называется ГЛАВНЫМ КВАНТОВЫМ
ЧИСЛОМ. Оно определяет энергетические
уровни атома водорода:
 .
Для
атома водорода в состоянии с заданным
главным квантовым числом n
ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО
принимает значения:
.
Для
атома водорода в состоянии с заданным
главным квантовым числом n
ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО
принимает значения:
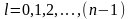 ,
определяя модуль орбитального
механического момента атома, т. е. момента
импульса электрона относительно ядра:
,
определяя модуль орбитального
механического момента атома, т. е. момента
импульса электрона относительно ядра:
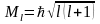 .
Магнитное
квантовое число
.
Магнитное
квантовое число
 при данном
принимает значения:
при данном
принимает значения:
 ,
и определяет проекцию орбитального
механического момента на произвольно
выбранное направление Z:
,
и определяет проекцию орбитального
механического момента на произвольно
выбранное направление Z:
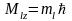 .
.
Спектральные
серии атома водорода. Группы
спектральных линий в атомных спектрах,
частоты которых подчиняются определенным
закономерностям, называются спектральными
сериями.
Наиболее четко они проявляются в спектрах
атомов и ионов с одним и двумя электронами
во внешней оболочке. Согласно правилу
отбора (Изменение
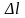 орбитального
квантового числа l удовлетворяет
условию
орбитального
квантового числа l удовлетворяет
условию
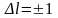 )
в спектре атома водорода наблюдаются
следующие серии:
– серия
Лаймана – переходы с р-уровней
на один и тот же уровень 1s,
т. е.
)
в спектре атома водорода наблюдаются
следующие серии:
– серия
Лаймана – переходы с р-уровней
на один и тот же уровень 1s,
т. е.
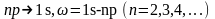 ;
– серия
Бальмера – переходы
;
– серия
Бальмера – переходы
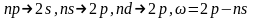 (n=3,4,5,…)
и т. д., где ω
– частота
испускаемой линии. Отметим, что
спектральная линия серии Лаймана,
соответствующая переходу
(n=3,4,5,…)
и т. д., где ω
– частота
испускаемой линии. Отметим, что
спектральная линия серии Лаймана,
соответствующая переходу
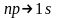 ,
является наиболее интенсивной.
Серия Лаймана,
как и серия Бальмера, обособлена,
остальные спектральные серии атома
водорода частично перекрываются.
,
является наиболее интенсивной.
Серия Лаймана,
как и серия Бальмера, обособлена,
остальные спектральные серии атома
водорода частично перекрываются.
