
- •§1. Макрокинетическая система.
- •§2. Основные задачи химической кинетики.
- •§3. Скорость химической реакции.
- •§4. Скорость простых химических превращений.
- •5. Реакции нулевого порядка.
- •§7. Последовательные реакции.
- •§8. Параллельные реакции.
- •§11. Кинетические уравнения обратимого химического проце-сса.Пусть имеем простую реак-цию:
- •§13. Колебательные режимы протекания химических реакций.При описании процесса окисления высших углеводородов используется модельная схема. Схема Вольтера:
- •§14. Элементарные понятия теории цепных реакций.
- •4. Стадия разветвления цепей.
- •§16. Окисление водорода при низком давлении, как пример црр.Рассмотрим одну из наибо-лее интересных реакций: окисле-ние водорода. Это высокоэнерге-тическая реакция.
- •§19. Элементы теории соударений.Данная теория была разработана и нашла широкое применение для газофазных реакций.
4. Стадия разветвления цепей.
Разветвлением цепей называется стадия цепного процесса, в кото-рой из одного активного центра образуется несколько.Так, любая цепная реакция складывается из этих четырех элементарных ста-дий, при чем стадия разветвления цепей может не иметь место. Цеп-ные реакции идущие с разветвл-ением цепей называются цепны-ми разветвленными реакциями ЦРР.(рис31)Если ветвление цепей не происходит в цепном процессе, то такая реакция называется цеп-ной неразветвленной реакцией ЦНР.(рис32)
Длина цепи. Совокупность пос-ледовательных реакций стадии продолжения цепи, из многокра-тного повторения которых скла-дывается цепной процесс, назы-вается звеном цепи. Звено цепи чаще всего состоит из двух элеме-нтарных реакций (возможно так-же большее их количество, напри-мер, четыре). Число полных зве-ньев приходящихся в среднем на каждый свободный радикал, обра-зовавшийся в стадии зарождения цепи, называется длиной цепи. Цепь может иметь конечную дли-ну из-за наличия стадии обрыва цепи, поэтому длина цепи опреде-ляется соотношением скоростей процессов обрыва и продолжения цепи. Пусть β – вероятность того, что на данном конкретном звене произойдет обрыв цепи, тогда 1-β – вероятность того, что цепь бу-дет продолжаться. Вероятность того, что цепь будет иметь длину n (т.е. цепь n раз продолжиться), а на n+1 произойдет обрыв, будет
![]() .
Рассмотрим сосуд. Пусть в нем на стадии
зарождения цепей возникло N
активных цент-ров, тогда число активных
цент-ров, длина цепей которых будет n
ра-вна
.
Рассмотрим сосуд. Пусть в нем на стадии
зарождения цепей возникло N
активных цент-ров, тогда число активных
цент-ров, длина цепей которых будет n
ра-вна
![]() ,
,
на них будет реализовано m коли-чество звеньев
![]() .
.
Всего в этом сосуде реализовано звеньев будет
![]() .
.
Длина цепи
![]()
![]()
![]() ,
,
,т. к. ряд сходящийся, поменяем порядок суммирования и диффе-ренцирования
![]() .
.
1-β<1, так как β является вероятностью, а вероятность все-гда меньше единицы. Тогда сумма представляет собой геометриче-скую прогрессию со знаменате-лем (1-β), сумма бесконечно убывающей геометрической про-грессии определяется по формуле
![]() ,
где a1
– первое слагае-мое в сумме, а q
– знаменатель прогрессии.Продолжим
равенство
,
где a1
– первое слагае-мое в сумме, а q
– знаменатель прогрессии.Продолжим
равенство
![]() .
.
Таким образом, длина цепи
![]() равна отношению
веро-ятности продолжения цепи и
ве-роятности обрыва (
равна отношению
веро-ятности продолжения цепи и
ве-роятности обрыва (![]() длинное звено, <<1).
Можно пе-рейти к скоростям процессов
про-должения цепи и обрыва цепи, поскольку
вероятности процессов пропорциональны
скоростям соо-тветствующих процессов,
тогда
длинное звено, <<1).
Можно пе-рейти к скоростям процессов
про-должения цепи и обрыва цепи, поскольку
вероятности процессов пропорциональны
скоростям соо-тветствующих процессов,
тогда
![]() ,
где
,
где
![]() - скорость про-должения цепи. Длина цепи,
пре-жде всего, зависит от природы
хи-мического процесса, например при
окислении водорода (H2+O2):
- скорость про-должения цепи. Длина цепи,
пре-жде всего, зависит от природы
хи-мического процесса, например при
окислении водорода (H2+O2):
![]() звеньев. Кроме того, длина цепи сильно
зависит от фи-зических условий, в которых
про-ходит цепной процесс.
звеньев. Кроме того, длина цепи сильно
зависит от фи-зических условий, в которых
про-ходит цепной процесс.
Скорость цепной
неразветвле-нной реакции ЦНР. Поскольку
при каждом акте зарождения цепи далее
следует развитие
звеньев цепи,
то скорость цепной реакции будет
пропорциональна как длине цепи, так и
скорости зарождения цепи![]() ,ν
– длина цепи, ω0
– скорость зарождения цепей.
,ν
– длина цепи, ω0
– скорость зарождения цепей.
Исходя из этого простого соот-ношения, возникает возможность управлять и изменять скорость ЦНР.
1). Скорость ЦНР может быть существенно увеличена воздейст-вием малых добавок в реакцио-нную систему веществ, которые способствуют образованию сво-бодных радикалов, т. е. сущест-венно увеличивают ω0, такие вещества называются инициато-рами.
2). Скорость ЦНР может быть значительно увеличена воздейст-вием на систему физических аген-тов, например, света или ионизи-рующих излучений, которые спо-собствуют образованию активных центров (фактически тем самым увеличиваем ω0, а, следовательно, ωЦНР).
3). Скорость ЦР в газовой фазе при небольших давлениях, как правило, сильно зависит от раз-меров реакционного сосуда, мате-риала, стенок реактора и их сос-тояния. Это связано с тем, что в газовых реакциях при небольших давлениях свободные радикалы, ведущие процесс, сравнительно легко диффундируют к стенке реакционного сосуда и в резуль-тате захвата стенкой гибнут на ней. Увеличение объема реагиру-ющей системы приводит к тому, что время диффузии к стенке уве-личивается, следовательно,
ωг уменьшается, ν увеличивается, ωЦНР возрастает. Специальная об-работка стенок реактора также может увеличить или уменьшить скорость гибели радикалов, сле-довательно, уменьшается или уве-личивается ν, а вместе с ней и ωЦНР.
4. Скорость ЦНР может быть рез-ко уменьшена добавлением в реа-кционную систему специальных добавок – ингибиторов. Ингиби-торы – это вещества, которые де-лают радикалы неспособными ве-сти химический процесс. В этом случае резко увеличивается ско-рость гибели активных центров, следовательно, уменьшается дли-на цепи и скорость самой реак-ции.
§15. Полимеризация,
как пример ЦНР.Процесс
полиме-ризации представляет собой ЦНР.
В 1934 году создатель теории цеп-ных
реакций Семенов Н. Н. ука-зывал, что рост
полимерной цепи обеспечивается наличием
на ко-нце растущей макромолекулы
свободной валентности, а длина цепи (в
смысле цепной теории) равна длине цепи
полимера, т. е. числу простых ядер в
молекуле полимера.
Полимерный
процесс в простейшем случае включает
три стадии.
1. Инициирование. На
этой стадии молекула мономера превращается
в реакционный центр, т. е. в частицу,
имеющую свободную валентность![]() ,
,
М – исходная молекула мономера, R1 – первый реакционный центр.
Это инициирование может проис-ходить различным путем:
1). Термический процесс. Актив-ные частицы образуются из моле-кул мономера под воздействием разогрева, при котором увеличи-вается тепловое движение моле-кул. Энергия теплового движения способствует разрыву связей в молекуле мономера и образуется активный центр.
М:![]() образовав-шаяся часть способна вступать
во взаимодействие с другими моле-кулами
мономера. Образовался активный центр
образовав-шаяся часть способна вступать
во взаимодействие с другими моле-кулами
мономера. Образовался активный центр
![]() радикал с 1 ядром мономера и двумя
валент-ностями.
радикал с 1 ядром мономера и двумя
валент-ностями.
2). Инициирование может проис-ходить под действием света или ионизирующего излучения. Связь рвется и возникает радикал, соде-ржащий одно ядро и две сво-бодные валентности.
3). Часто для
инициирования при-меняются специальные
вещества инициаторы. Они легко вступают
во взаимодействие с молекулой мономера,
в результате чего обра-зуется радикал,
имеющий свобод-ную валентность
![]() ,
,
где I – инициатор.
2. Развитие цепи.
После
иници-ирования начинает расти полиме-рная
цепь. Ее рост – это последо-вательность
реакций типа
![]()
![]() ,
…,
,
…,
![]() .
.
![]() Такой
процесс может идти в сис-теме до тех
пор, пока там имеют-ся молекулы мономера.
Такой
процесс может идти в сис-теме до тех
пор, пока там имеют-ся молекулы мономера.
3. Обрыв цепи. В процессе поли-меризации есть стадия, которая приводит к обрыву реакционной цепи:
1). Если активные концы двух Ра-стущих молекул встречаются, то они взаимодействуют и образуют конечный продукт – полимер, ко-торый в химическом взаимо-действии больше не участвует.
![]() ,где Pi+j
– полимер
длиной i+j.
,где Pi+j
– полимер
длиной i+j.
![]() ,
,![]() .
.
2). Также может происходить пре-кращение роста цепи в результате взаимодействия растущей молеку-лы с какими-либо постоянными примесями, находящимися в сис-теме или со стенкой сосуда. Осно-вными факторами, которые будут определять процесс полимериза-ции, будут являться рассмотре-нные стадии и гибель цепи за счет взаимодействия двух радикалов (другая гибель будет незначитель-на). Рассмотрим процесс в случае, когда инициирование будет про-исходить с помощью инициатора и определим кинетические зако-номерности.
1).![]() (kо
– константа скорости образования),
(kо
– константа скорости образования),
2).![]() ,
,
3).![]() .Кинетические
уравнения запишем, используя закон
действующих масс:
.Кинетические
уравнения запишем, используя закон
действующих масс:
![]() (1)
(1)
Будем рассматривать процесс в сосуде с усредненными характе-ристиками. Т. е. в любой точке сосуда концентрация M, Ri и Pj одна и та же, и температура постоянна. Обычно эти условия выполняются в реакторе идеаль-ного смешения, в котором проис-ходит интенсивное перемешива-ние реагирующей смеси.
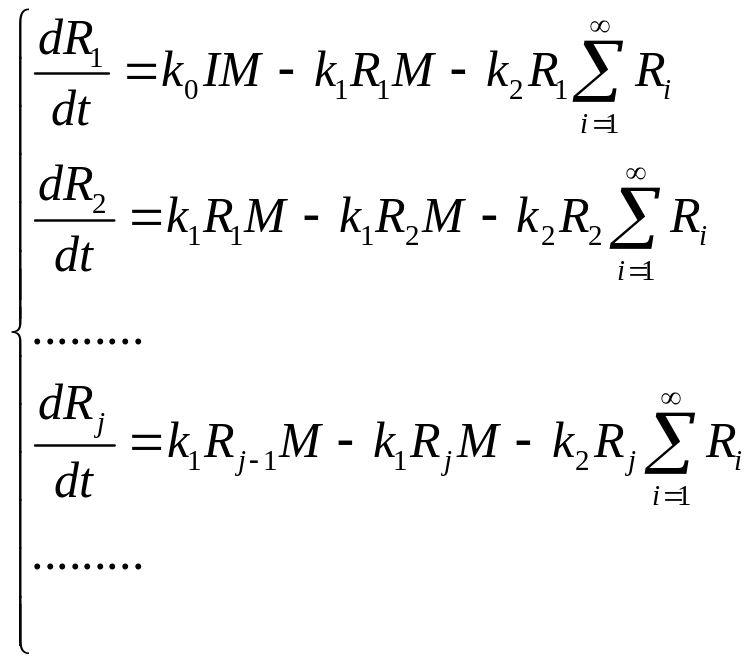 (2)
(2)
Ограничимся рассмотрением расхода мономера, т. к. процесс, в принципе, определяется этой величиной (для полимера урав-нения выписывать не будем).
Обычно когда
исследуется ско-рость расхода мономера
можно следить за расходом всех Ради-калов
вместе.
![]() ,
,
где R – концентрация радикалов, безразлично какой длины.Если сложить все уравнения типа (2) то получим:
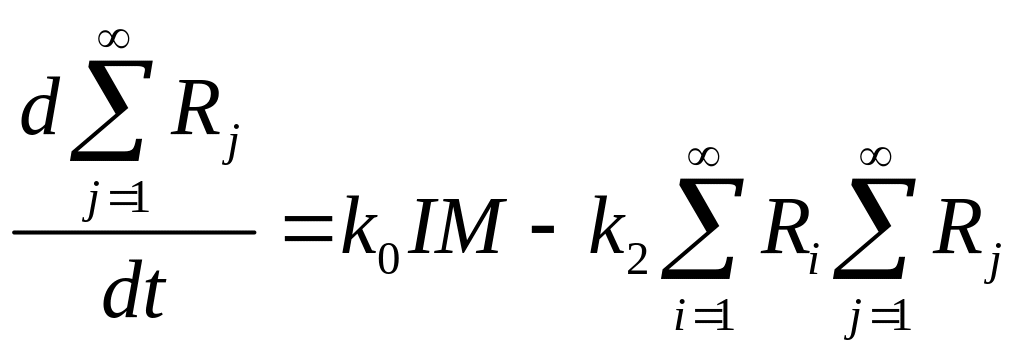
Получаем уравнения
![]() ,
(1’)
,
(1’)
![]() .
(2’)
.
(2’)
Эти уравнения будут
определять скорость и условие окончания
процесса. Радикалы – активные частицы,
поэтому они быстро вступают во
взаимодействие, и их концентрация быстро
выходит на постоянный уровень, т.е. также
как и в методе квазистационарных
концентраций, спустя некий про-межуток
времени после запуска процесса в системе
устанавлива-ется![]() ,и
поэтому из уравне-ния
,и
поэтому из уравне-ния
![]() мы можем найти квазис-тационарную
концентрацию R:
мы можем найти квазис-тационарную
концентрацию R:
![]() .Квазистационарная
концентрация Радикала равна
.Квазистационарная
концентрация Радикала равна
![]() .
.
Тогда
![]() принимает вид:
принимает вид:
![]() -
скорость
полимеризации
(Ра-ботает, когда в системе много
по-лимера). Такое приближение дает
хороший результат в рабочей ста-дии
процесса.(Рис33)
-
скорость
полимеризации
(Ра-ботает, когда в системе много
по-лимера). Такое приближение дает
хороший результат в рабочей ста-дии
процесса.(Рис33)
t1t2 – рабочий промежуток проце-сса, при t<t1 много мономера, при t>t2 мало.
![]() ,(M
большая).
,(M
большая).
Данное выражение можно проин-тегрировать
![]() ,
,
![]()
![]() .Согласно
нача-льным условиям
.Согласно
нача-льным условиям
![]() ,
тогда
,
тогда
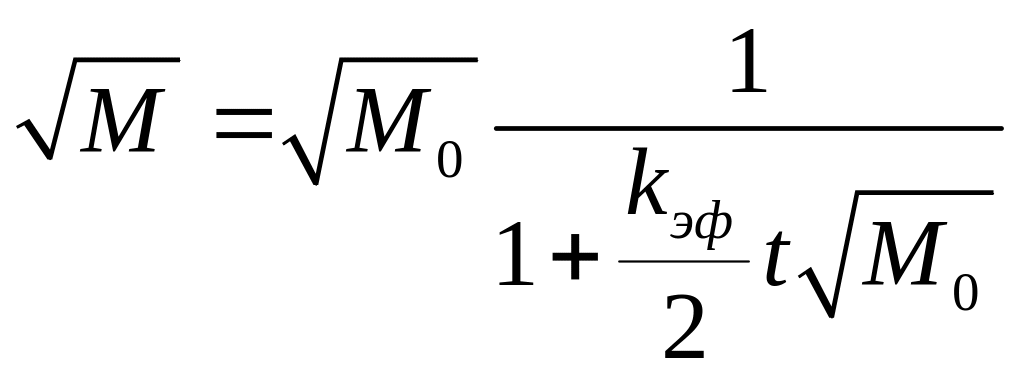 ,
,
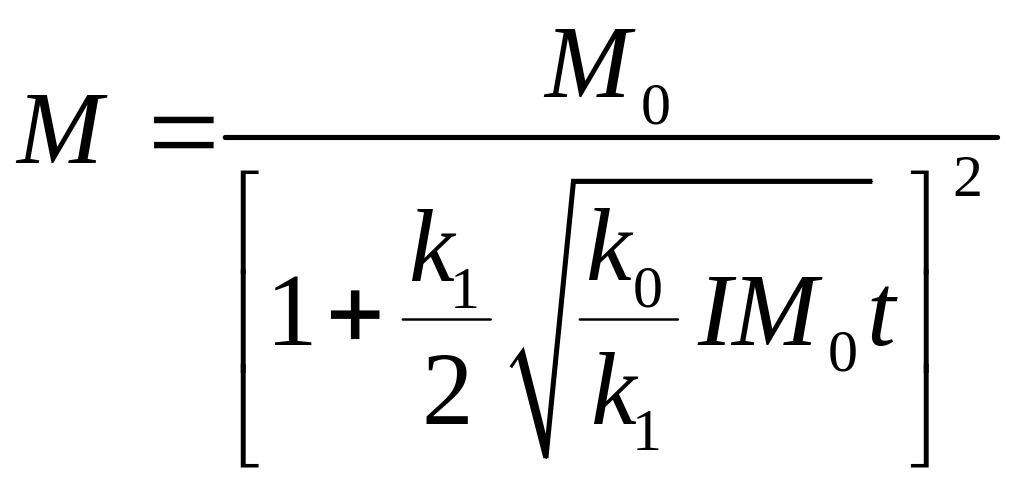 .
.
Полученная формула справедлива для рабочего промежутка.
![]() служит формальным
приз-наком того, что в реакцию входят
свободные радикалы (скорость в степени
½). В конце процесса, ко-гда концентрация
M
будет мала, определять скорость
химического процесса будет первое
слагаемое (
служит формальным
приз-наком того, что в реакцию входят
свободные радикалы (скорость в степени
½). В конце процесса, ко-гда концентрация
M
будет мала, определять скорость
химического процесса будет первое
слагаемое (![]() ).
).![]() .Тогда
.Тогда
![]() ,
как это было для случая простой реакции.
Если менять температуру системы в хо-де
самого процесса, то законноме-рности
прохождения процесса бу-дут совершенно
другие, посколь-ку меняются k0,
k2
и k2.
На этом эффекте был разработан новый
метод полимеризации:
,
как это было для случая простой реакции.
Если менять температуру системы в хо-де
самого процесса, то законноме-рности
прохождения процесса бу-дут совершенно
другие, посколь-ку меняются k0,
k2
и k2.
На этом эффекте был разработан новый
метод полимеризации:
Еникалопов Н. С. – «Метод фрон-тальной полимеризации» (исполь-зованы идеи теории горения).(рис34)Движение фронта полимеризации в результате воз-действия высокой температуры приводит к тому, что полимериза-ция идет вдоль по всему реактору.
