
- •Тема 1.Основные классы неорганических соединений
- •Тема 2.Эквивалент.Закон эквивалентов.Расчёт молярных масс эквив. Простых и сложных в-в.
- •Тема 3.Энергетика
- •Тема 4.Внутренняя энергия и энтальфия.
- •Тема 5.Скорость хим.Реакций.
- •Тема 6.Физико-химические свойства. Растворы неэлектролитов.
- •Тема 7.Ионное произведение воды.Рн р-ра.
- •Тема 8.Гидролиз по катиону
- •Тема 9.Окислительно-восстановительные р-ции.Степень окисления.Типичные окислители и восстановители.
- •Тема 10.Химические источники электрической энергии.Электродный потенциал его измерение.Стандартный электродный потенциал.
- •Тема 11.Уравнение Нернста
- •Тема 12.Электролиз.
- •Тема 13.Общая характеристика ме
Тема 10.Химические источники электрической энергии.Электродный потенциал его измерение.Стандартный электродный потенциал.
Для определения направления и полноты протекания окислит.-востановит. р-ции между окислит.-востановит. системами в водных растворах используются значения в электродных потенциалах этих систем.Механизм возникновения электродных потенциалов их количственноеопределение процессы которые сопровождаются возникновением электрического тока или вызваны электрич. током изучаются разделом химии называемым электрохимия .К электрохимии относятся явления возникающие на границе раздела двух фаз с участием заряженных частиц ионов и электронов.Для всех МЕ характерно свойство в большей или меньшей степени растворятся в воде.При этом в р-р уходят катионы МЕ и концентрируются у его поверхности , а сама пластина заряжается отрицательно.В результате чего на границе раздела двух фаз возникает двойной электрич. слой характер. некоторой разностью потенциалов. Между пластиной и раствором наступает следующее равновесие.
Стандартный электродный потенциал.
Абсолютное значение СЭП измерить не возможно. поэтому определяют разность потенциалов между потенциалом исследуемой системы и потенциалом электрода сравнения. В качестве электрода сравнения используют стандартный водородный электрод.
Свойства ряда напряжения МЕ.
1.В начале ряда напряжений располож. МЕ активные восстановители.
2.МЕ имеющие потенциал меньше чем -0,41 В способны вытеснить Н из воды.Исключ. составн. МЕ кот. покрыв. ионной плотной плёнкой оксида Zn,Al,Mg
3.МЕ имеющ. Потенциал меньше 0 способны вытеснять Н из кислот не окислителей HCl,HB,H2SO4
4.МЕ у кот потенциал больше 0 не вытесняют Н из кислот но взаимодействуют с кислотами окислит.HNO3,H2SO4
5.МЕ кот. стоят левее (более актив.) вытесняют МЕ которые стоят в ряду правее (менее активн.) из растворов их солей.
Зависимость значения стандартного электронного потенциала от конц. и рН электролита.
Если концентр. ионов МЕ в р-ре не соответствует 1 моль/л, то потенциал необходимо пересчитать.
Тема 11.Уравнение Нернста
ме=
0ме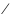 ме+
ме+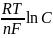 меn+
меn+
Коррозия МЕ –самопроизвольное разрушение МЕ под действием окруж. среды
Коррозия делится: химическая (протекает при отсутствии электролитов без возникновения электрического тока в системе), электрохимическая (протекает в присутствии электролитов без возникновения электрического тока в системе).
Химическая: газовая(протекает в среде газов окислителей ней О2), жидкостная(в не водных органических средах (в нефтепродуктах содержит серу и галогены)).
Электрохимическая :коррозия в среде электролитов, атмосферная, почвенная, коррозия под действием электрич. тока.
По типу коррозионного разрушения подразделяется: равномерная, местная(пятна),межкристаллическая(на границе зёрен МЕ не видно).
Показатели коррозий
Весовой
Кт=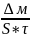 ;
Объёмный Кv=
;
Объёмный Кv=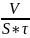 ;
Глубинный П=
;
Глубинный П=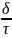 :
:
Электрохимическая коррозия
Причиной возникновения является химическая неоднородность МЕ, контакт двух МЕ с различ. потенциалами и наличие коррозионной среды в виде электролита.
