
- •Тема 1.Основные классы неорганических соединений
- •Тема 2.Эквивалент.Закон эквивалентов.Расчёт молярных масс эквив. Простых и сложных в-в.
- •Тема 3.Энергетика
- •Тема 4.Внутренняя энергия и энтальфия.
- •Тема 5.Скорость хим.Реакций.
- •Тема 6.Физико-химические свойства. Растворы неэлектролитов.
- •Тема 7.Ионное произведение воды.Рн р-ра.
- •Тема 8.Гидролиз по катиону
- •Тема 9.Окислительно-восстановительные р-ции.Степень окисления.Типичные окислители и восстановители.
- •Тема 10.Химические источники электрической энергии.Электродный потенциал его измерение.Стандартный электродный потенциал.
- •Тема 11.Уравнение Нернста
- •Тема 12.Электролиз.
- •Тема 13.Общая характеристика ме
Тема 8.Гидролиз по катиону
1.Записываем формулу соли +Н2О
2.Выясняем каким основанием и какой кислотой образована соль и силу этих в-в.
3.Записываем уравнение диссоциации соли
4.Находим одноимённый ион со слабым основанием
5.К этому иону прибавляем Н2О
Константа, степень и рН гидролиза
1.Костанта гидролиза соли овраз. Слабым основанием
Кт=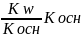 -
-Константа основания;
-
-Константа основания;
Слабой
кислотой Кт=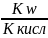 ;
Двумя слабыми электролитами Кт=
;
Двумя слабыми электролитами Кт=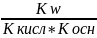 ;
;
2.Степень
гидролиза – отношение числа гидролизованных
молекул к общему числу молекул.h=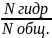
3.рН гидролиза. рН‹7 кислая рН›7 щелочная
рН=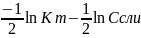 роН==
;
рН=14-роН
роН==
;
рН=14-роН
Тема 9.Окислительно-восстановительные р-ции.Степень окисления.Типичные окислители и восстановители.
-р-ции сопроваждающиеся изменением степени окисления атомов или молекул реагирующих в-в.
Окисление-прцесс отдачи атомов ионов или молекул и электронов.
Восстановление-процесс присоединения атомов молекулы или ионов электронов.
Окислитель-служит нейтральный атом молекулы или ион приним. электроны, а восстановитель отдающий.
Восстановители в процессе р-ции окисляются , а окислители восстанавливаются.
Степень окисления простых в-в равна 0, кислорода -2, водорода +1, элементов 1А, 2А, 3А соответственно +1,+2,+3.
Типичные восстановители
Восстановителями могут быть атомы и ионы.
1.все МЕ до Н
2.все отриц. заряж. ионы (ионы не МЕ имеющие низкую степень окисления )Сl +1,-1,0.
3.Ионы Ме имеющие низкую степень окисления
Типичные окислители
окислителями могут быть нейтральные атомы положит. заряж ионы
1.атомы галогенов
2.ионы МЕ высшей степени окисления.
3. ионы не МЕ высшей степени окисления.
Метод электродного баланса.
Металлы в ряду напряжений подразделяются на 3 группы:
1. Активные МЕ до Zn
2.все, что правее Zn до Н (средней активности)
3.Правее Н(МЕ малой активности)
Классификация окислительно-восстановительных р-ций.(ОВР)
ОВР-бывают 3 типов.
1.межмолекулярные р-ции в ходе кот. в-тель и о-тель нах. в разных в-вах
2.внутремолекулярные р-ции в ходе кот. в-тель и о-тель нах. в сост.одного в-ва
3.диспропорционирования (самоокисления, самовосстановления) р-ции в ходе кот. атомы одного и того же элемента явл.и окислителем и восстановителем
Влияние условий на протекание окислит.-востановит. р-ций
На протекание ОВР оказывают вляние:природа реагр. в-в их концентрация и рН среды.(конценр. и разбавл. азотная к-та по разному востанавл. При взаимод. с одним и тем же восстановителем)
Закон эквивалентов для окислит.-востановит р-ций
nэкв(ОН)=
nэкв(востан)
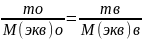 Сэкв*Vр-ра(ок)=
Сэкв*Vр-ра(ок)=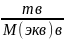 Сэкв(в)*Vр-ра(в)=
Сэкв(в)*Vр-ра(в)=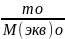
Направление протекания окислит.-восстановит р-ции
∆rG(298K)=-Z*E*F Z-HOK,E-напряжение процесса,F-число Фарадея 96500 К л⁄моль экв.
Е=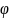 ок-
вост
Кс=
ок-
вост
Кс=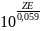 Кс-константа
равновесия Кс-определяет
глубину протекания.
Кс-константа
равновесия Кс-определяет
глубину протекания.
