
- •Тема 1.Основные классы неорганических соединений
- •Тема 2.Эквивалент.Закон эквивалентов.Расчёт молярных масс эквив. Простых и сложных в-в.
- •Тема 3.Энергетика
- •Тема 4.Внутренняя энергия и энтальфия.
- •Тема 5.Скорость хим.Реакций.
- •Тема 6.Физико-химические свойства. Растворы неэлектролитов.
- •Тема 7.Ионное произведение воды.Рн р-ра.
- •Тема 8.Гидролиз по катиону
- •Тема 9.Окислительно-восстановительные р-ции.Степень окисления.Типичные окислители и восстановители.
- •Тема 10.Химические источники электрической энергии.Электродный потенциал его измерение.Стандартный электродный потенциал.
- •Тема 11.Уравнение Нернста
- •Тема 12.Электролиз.
- •Тема 13.Общая характеристика ме
Тема 1.Основные классы неорганических соединений
Химия-наука о в-вах и превращения в-в при кот. изменяется их структура и свойства.
В-ва простые(кислород ,озон, фосфор),сложные{органич. не органич(соли,оксиды,основания,кислоты)}
Оксиды.Свойства.наменклатура.
-бинарные соединения элемента с кислородом.ЭхОу
Признаки
*в оксидах степень окисления кислорода всегда -2
*атомы кислорода в оксиде не связаны между собой т.н. кислородными источниками(PbO2,Na2O2)
*степень окисления элемента в оксиде постоянна (Pb2О3)
Оксиды
Солеобразующие Кислотные,основные,амфотерные
Кисл.-оксиды кот.прямо или косвенно взаимодействия с водой образуют кислоту(SO2, SO3).Кислот.осн. взаимодействуют с основаниями и основными оксидами образуют соль.
Основные – оксиды кот. прямо или косвенно взаимодействия с водой образуют основание.( Na2O).при взаимод.с кислотами или кислот.оксидами образ.соль
Амфотерные-проявляют свойства как кислотных так и основных оксидов Al2O3.
Если элемент образ. оксид находится в 1А,2А и 3А группе переодич системы, то он имеет постоянную степень окисления, соответствующий номер в котором он находится.
Основания
-сложное соединение в котором при диссоциации в водных растворах образуют онеоны одного типа.
Растворимые –основания кот. Образуют 1А,2А группы щелочные щелочноземельные
Малорастворимые все остальные.
Кислоты
Бескислородные HCL,HBr,HCN
Кислородосодержащие
Соль
-продукты замещения атомов водорода в кислоте на МЕ или гидроксильных групп в основании на кислотный остаток.
Средние, кислые основные, бес кислородные.
Тема 2.Эквивалент.Закон эквивалентов.Расчёт молярных масс эквив. Простых и сложных в-в.
Эквивалент- условное или реальная частица в-ва в Z раз меньшая его формульной единицы. Величина Z определяется из уравнения реакции ед. кол-ва в-ва в химии является моль.
Моль-это
такое кол-во в-ва кот, сод.столько
формульных единиц сколько атомов
содержится в изотопе углерода
с массой 12гр.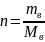 1)Молярная
масса в-ва эквив.-отношение
молярной массы элемента на его
валентность.
2)Молярная
масса эквив. оксида (молярная м эквив.окс.=
молярная м эквив.элемента+ молярная м
эквив.О)
1)Молярная
масса в-ва эквив.-отношение
молярной массы элемента на его
валентность.
2)Молярная
масса эквив. оксида (молярная м эквив.окс.=
молярная м эквив.элемента+ молярная м
эквив.О)
3)Опред.
молярн. м кислоты (молярная м
эквив.кисл=молярная кислоты разделить
на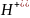
4)Основания(молярная
м эквив.основ= молярная м основ. Разделить
на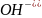 )
)
5)соли(молярная м эквив.соли= молярная м соли разделить на валентность на число)
Способы выражения состава раствора.
Состав растворов в химии принято выражать концентратами.Концентраты(безразмерные-относят молярную и массавую доли.Размерные молярная концентрация , концентр. эквивалентов в-ва,моляльность и титр.)
1)массовая доля=м в-ва разделить на м р-ра*100%
2)молярная доля в-ва=кол-во в-ва разделить на сумму кол-ва в-ва и кол-во Н2О
3)молярная концентрация(молярность)= кол-во в-ва разделить на V р-ра
4)молярная концентрация эквивалентов в-ва(нормальность)= кол-во в-ва разделить на V р-ра
5)Моляльная концентрация(моляльность)= кол-во в-ва разделить на м р-ра*1000
6)Титр=м в-ва разделить на V р-ра
