
- •Тема 1.Основные классы неорганических соединений
- •Тема 2.Эквивалент.Закон эквивалентов.Расчёт молярных масс эквив. Простых и сложных в-в.
- •Тема 3.Энергетика
- •Тема 4.Внутренняя энергия и энтальфия.
- •Тема 5.Скорость хим.Реакций.
- •Тема 6.Физико-химические свойства. Растворы неэлектролитов.
- •Тема 7.Ионное произведение воды.Рн р-ра.
- •Тема 8.Гидролиз по катиону
- •Тема 9.Окислительно-восстановительные р-ции.Степень окисления.Типичные окислители и восстановители.
- •Тема 10.Химические источники электрической энергии.Электродный потенциал его измерение.Стандартный электродный потенциал.
- •Тема 11.Уравнение Нернста
- •Тема 12.Электролиз.
- •Тема 13.Общая характеристика ме
Тема 3.Энергетика
раздел химии кот. изуч. закономерности превращения одних форм энергии в другие назыв.-термодинамикой
хим.термодинамика рассматривает применение законов термодинамики хим.процессов.Раздел хим. термодинамики изучающий тепловые эффекты хим.реакций и их зависимость от хим. состава строения в-ва а так же от условий протекания реакций назыв. –теплохимией.
Основные понятия термодинамики
1.Термодинамич. система –совокупность в-в физически и мысленно обособленных от окруж.среды.
Различат 3 типа систем:открытые(происходит обмен с окруж.средой как в-ву так и энергией),замкнутые(обмен происходит только с энергией),изолированные (отсутствует обмен).
Изменение состояния системы т.е. переход её из одного состояния в другое-процесс.В зависимости от условия протекания процесса различают изотермический Т-конст.,изобарный Р-конст., изохорный Vкост, адиабатный Q.
Тепловые эффекты хим.реакций
-кол-во энергии кот. выделяется или поглощается при протекании хим.реакции.Тепловой эффект относится к тому кол-ву в-ва в которое указано в хим. реакции.Если р-ция протекает с выделением тепла она называется экзотермической, если с поглащением-эндотермической.
Тема 4.Внутренняя энергия и энтальфия.
При протекании хим.изменяется реакции изменяется внутренняя энергия системы. Внутренняя энергия – полная энергия системы включающая в себя энергию молекул атомов , ионов , электронов внутреннюю энергию за исключением потенциальной энергии в целом.Внутр. энергию измерить не возможно поэтому определяют её разницу при переходе систем из одного состояния в другое.
Согласно
1 закону термодинамики теплота
передаваемая системе расходуется на
изменение внутр. энергии и совершения
работы. Для сравнения энтальпии разн.
систем их приводят к стандартным
условиям(Т=298К,Р=101,325кПа).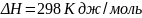
Энтальпия сгорания в-ва –тепловой эффект сгорания 1 моль в-ва до газообразного СО2 и Н2О
Термохимические законы.
Позволяют рассчитать тепловой эффект процесса без постановки эксперимента.
1.закон Лавуазье- Лапласа.Тепловой эффект реакций разложения в-ва равен и противоположен по знаку тепловому эффекту его образования
2.Закон Гесса. Тепловой эффект хим.реакции зависит только от начального и конечного состояния в-ва и не зависит от пути протекания процесса. Изменение энтальпии хим. реакции равно сумме энтальпий образования продуктов р-ции -сумму энтальпий исходных в-в с учётом стехеаметрических коэффициентов.
Энтропия.
-критерии непорядочности системы кот. рассчитывается через термодинамическую вероятность.
Любая термодинам. система характеризуется макро и микро состоянием. Микро – сост. каждой частицы в отдельности
Макро- сост. системы в целом.
Термодинамич. вероятность это число микро состояния соответствующих одному макро сост.
Тема 5.Скорость хим.Реакций.
= числу атомов взаимодействия в 1 времени в единице реакционного пространства.
Реакционное
пространство-объём, а для гетерогенной
площадь раздела фаз.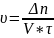 ;через
концентрацию
;через
концентрацию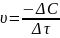
Скорость хим.р-ции зависит от природы реагирующих в-в их концентрацию давление(для газообразных),температуры, катализатора и площади поверхности раздела фаз(для гетерогенных).
Влияние концентраций реагирующих в-в их скорость хим.реакции.
Реакции элементарные (протекают в одну сторону), сложные(протекают в несколько стадий).Для простых р-ций применим закон действия масс(закон Гольдберга и Вонге)Для элементарных р-ций скорость хим. р-ций при данных условиях прямопропорциональна концентрации реагирующих в-в в степенях равных их стехиаметрич. коэффициентов.
Влияние
Т на скорость хим. р-ции.Правило Вант-Гоффа
.Зависимость скорости р-ции от Т можно
определить с помощью зависимости
вант-гаффа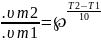 когда Т2
когда Т2 Т1
Т1
Уравнение Аррениуса . энергия активации
Согласно данной теории р-ция между в-вами может проходить только столкновением активных частиц.
Активными-назыв. Частицы кот. обладают определённо характерной для данной р-ции энергией , необходимой для преодоления сил сталкивания возникающих между электронами оболочками частиц. Активные частицы при столкновении могут образовать промежуточную неустойчивую группировку наход. в сост. перераспределения связи.(Активированный комплекс).
Влияние
Т на скорость хим. р-ций выражается
уравнением Аррениуса для константы
скорости хим. р-ций .К=А*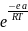 /
/
A-предэкспонециальный множитель. е-основане натур. логарифма.еа-энергия активации .
Катализ
-явление изменения скорости р-ции присутствии особых в-в в катализаторе.
Катализатор- в-ва кот. изменяют скорость хим.р-ции в следствии многократного участия в промежуточном взаимодействии реагентом р-ции.но после каждого цикла промежут. взаимод. востанавлив . свой хим. состав.
Катализ-положительный (ускоряет р-цию ).Отриц.-замедляет.
Если катализатор и реагирующие в-ва нах. в одой фазе, то катализ называется гомогенным , если в разных то гетерогенным.Гомогенный кат. осущ через.промеж. р-ции с катализаторами в результате чего происходит замена одной р-ции с высокой энергией активации несколькими у кот. энергия актив. ниже. Это и ускоряет хим. р-цию.
Катализаторы для гомогенного катализа-кислоты, основания, соли хрома , марганца, железа, кобальта, меди.
Гетерогенный катализ протекает в несколько стадий .Нач. стадия это подвод реагентов в зону р-ции и поглощение их частиц поверхностью катализатора. При гетерогенном катализе р-ция так же протекает через активные промежуточные соединения , кот. представляют собой поверхностные соединения катализатором с реагирующими в-вами. Для гетерог. кат. используют тонкоизмельчённые порошки кот. наносят на инертную основу. Использ. Порошки из железа , оксида мели никеля, платины.
Химическое равновесие.
Обратимые и необратимые хим. р-ции
Не обратимые р-ции протекают до конца до полного расхдывания реагентов. А обратимые до конца не доходят не расходуются полностью.Хим. обрат. р-ции при данных условиях как в прямом так и в обратном направлении протекают.
Конст. равновесия –термодинамич. величина , зависит от термодинамич. уравнений системы.
Принцип Ле Шателье
Если на систему ноход. в сост. равновесия воздействовать из вне, то в результате протекающих в ней процессов равновесия сместится в сторону, где это воздействие ослабевает.
Применим к состоянию истинного хим. равновесия признаками которого являются следующие :
1.состояние системы остаётся неизменным при отсутствии внешнего воздействия .
2.состояние системы изменяется под влиянием внешних воздействий сколь малы бы они не были.
3.состоящие системы не зависят от того с какой стороны система подобна к равновесию.
Влияние давления
Для определения влияния давления необходимо подсчитать число газовых моль слева и справа от знака =
При повышении давления в системе равновесие сместится в сторону меньшего числа газовых моль.
