
- •Тема 1.Основные классы неорганических соединений
- •Тема 2.Эквивалент.Закон эквивалентов.Расчёт молярных масс эквив. Простых и сложных в-в.
- •Тема 3.Энергетика
- •Тема 4.Внутренняя энергия и энтальфия.
- •Тема 5.Скорость хим.Реакций.
- •Тема 6.Физико-химические свойства. Растворы неэлектролитов.
- •Тема 7.Ионное произведение воды.Рн р-ра.
- •Тема 8.Гидролиз по катиону
- •Тема 9.Окислительно-восстановительные р-ции.Степень окисления.Типичные окислители и восстановители.
- •Тема 10.Химические источники электрической энергии.Электродный потенциал его измерение.Стандартный электродный потенциал.
- •Тема 11.Уравнение Нернста
- •Тема 12.Электролиз.
- •Тема 13.Общая характеристика ме
Тема 6.Физико-химические свойства. Растворы неэлектролитов.
Растворимость-способность в-ва растворятся в том или ином растворителе.
Мера растворимости-при данных условиях явл. его содержание в насыщенном р-ре.
Насыщенный
р-р –если он находится в равновесии с
растворяемым в-вом. G0=0
G0=0
Растворимость зависит от природы раств. в-ва и природы растворителя. От их агрегативного состояния. Наличие в р-ре пост. примесей, температуры и давления.
Физические свойства вводы
1.Чистая вода-бесцветная,прозрачная жидкость.
2.При переходе из твёрдого состояния в жидкое плотность воды растёт .при 40С мах. При дальнейшее повышении Т падает.
3.вода имеет высокую теплоёмкость 4,18 Дж(г*к)
4.Молекула воды имеет угловое строение(образующие ядра расположены в виде равнобедренного треугольника в основании кот. имеются 2 протона, а в вершине ядро атома кислорода)
5.молекулярная масса =18гр/моль. Однако молекулярная масса жидкой воды больше т.к. молекула жидкой воды способна оссациироваться в агрегаты.
6.Плотность льда несколько ниже т.к. лёд имеет поры размеры кот. больше чем размер молекулы воды.
Химические свойства воды
1.Вода взаимодействует с активными МЕ с образованием щелочей.
2.С менее активными МЕ с образованием оксидов.
3.С не МЕ с образ. оксидов
4.С кислотными оксидами с образованием кислот
5.С основными оксидами с образованием щелочей
6.некот. соли при взаимод. с водой подверг. гидролизу.
7.Вода образует кристаллогидраты Na2SO4,CaSO4
8.Является слабым окислителем и сильным восстановителем
9.При электролизе разлагается на кислород и водород.
10.При
термич. диссоциации 2H2O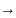 2H2
2H2 +O2
+O2
Закон Рауля и Вант-Гоффа для р-ров не электролитов.
Не электролиты -в-ва кот. не диссациируют в водном р-ре на ионы и следовательно их р-ры и расплавы не проводят электрический ток.
1 закон Рауля: понижение давления насыщенного пара над раствором по сравнению с чистым растворителем прямопропорционально числу моль растворённого в-ва и обратно пропорционально числу моль растворителя.
Формула
Рауля
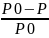 =
=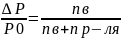
2 закон Рауля:повышение Т0С кипения р-ра и понижения Т0С его замерзания прямопропорционально моляльности в-ва.
Закон Вант-Гоффа
Осмос , осмотическое давление.
Осмос-односторонняя диффузия возникающая в р-рах при наличии полу проницаемой перегородки которая может пропустить через себя молекулы растворённого в-ва.
Вант-Гофф пологая поведение растворённого в-ва в р-ре аналогично поведению в газообразном состоянии предложил для определения осмотического давления формулой Менделеева-Клапейрона
Тема 7.Ионное произведение воды.Рн р-ра.
Вода как слабый амфотерн диссоциирует на катионы водорода и гидоксида.
рН=-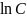 н+
Сн+=Скисл*
н+
Сн+=Скисл*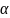 *n
-степень
диссоциации
*n
-степень
диссоциации
n-число катионов Н в ур. диссоциации
Произведение растворимости
Вычисляется для малорастворимых солей. Произведение растворимости есть величина = произведению концентрации ионов в степенях равных их стехеометрич. коэффиц. в уравнении диссоциации.
Ионно-молекулярные уравнения
Правила написания ионно-молекулярных уравнений:
В ионно-молек. уравн.сильные электролиты записывают в виде ионов ,а слабо диссоциирующие малораствор. и газообразные в-ва в виде молекул.
1.образование слабодиссоциирующих соединений
2.При взаимодействии 2-ух сильных электролитов образуется слабодиссоциирующие и вода.
Гидролиз солей
Гидролизам называется взаимодействие соли с водой при кот. изменяется рН среды.3 типа: по катиону(слабым основанием и сильной кислотой),по аниону (наоборот),смешанного типа(слабым основанием и сильной кислотой)
