
- •1. Рух об’ємного тіла в центральному полі
- •9.1. Динаміка спеціальної теорії відносності; 9.2. Релятівський імпульс; 9.3. Маса і енергія релятівської частинки та їх взаємний зв»язок.
- •9.4.Основні поняття релятівської динаміки матерільної точки
- •9.6.Поняття про загальну теорію відності
- •9.7.Межа застосування класичної механіки
- •13.2 Робота газу при зміні його об’єму
- •13.3(4. Закон рівного розподілу енергії по ступеням вільності молекули) Число ступенів вільності молекули
- •13.4 Внутрішня енергія термодинамічної системи
- •13.6 Теплоємність
- •13.9 Класична теорія теплоємності та її обмеженість
- •14.Статистичний розподіл.
- •14.2 Закон Максвела для розподілу молекул ідеального газу за швидкостями та енергіями теплового руху
- •14.3 Барометрична формула
- •14.4 Закон Больцмана для розподілу частинок у зовнішньому потенціальному силовому полі
- •15. Явища переносу у газах.
- •15.1 Молекулярно-кінетична теорія явищ переносу у газах.
- •15.2 Среднє число зіткнень і середня довжина вільного пробігу молекул
- •15.4. Дослідні закони дифузії
- •15.5.Дослідні закони теплопровідності та внутрішнього тертя та їх мол.-кін. Тлумачення
- •16.Другий закон термодинаміки.(16.1)
- •17.3.Рівняння Ван-дер-Ваальса(17.2.Відступи від законів ідеальних газів)
- •17.4.Ізотерми реальних газів
- •17.5. Внутрішня енергія газу.
- •19. Електростатичне поле у вакуумі. 19.1.Електричне поле.
- •19.4. Напруженість і потенціал електричного поля
- •19.7.Метод суперпозиції та його застосування до розрахунку електричних полів.
- •19.8.Теорема Остроградського-Гауса.
- •19.11.Обчислення напруженості поля на підставі теореми Гауса.
- •20. Електричне поле в діелектриках.
- •20.1. Діелектрик в зовнішньому силовому полі
13.2 Робота газу при зміні його об’єму
Робота газом виконується тільки при зміні його об’єму! Елементарна робота : dA=pdV
Якщо треба зн. кінц. Роботу,то: А=V1∫V2pdV
Для обчислення роботи при змінному тиску треба знайти закон зміни в залежн. Від об’єму. Якщо p=const, то: A=p∆V=p(v2-v1)
Якщо тиск змінюється лінійно: P=P0+ἀV
Підрахуємо роботу,яку виконує газ при коловому процесі: на ділянці А12>0, А12=S1 на ділянці А21=S2
A=A12-A21=S3 В інших координатах такий аналіз неможливий.
13.3(4. Закон рівного розподілу енергії по ступеням вільності молекули) Число ступенів вільності молекули
Ступенями вільності механічної системи називають незалежні змінні, які потрібно задати, щоб визначити положення системи у просторі.
Принцип
рівнорозподілу енергії за ступенями
вільності.
Ні
один з видів руху молекули не має переваги
перед іншими, тому на будь-яку
ступінь вільності молекули у середньому
припадає однакова кількість енергії:
 (2.6)
(2.6)
Тоді середня енергія теплового руху молекул:
 (2.7)
де
(2.7)
де
![]()
(2.8)
nпост – кількість поступальних ступенів вільності;
nоб – число обертальних ступенів вільності;
nкол – число коливальних (коливальні ступені вільності мають вдвічі
більшу енергоємність, ніж поступальні й обертальні, і тому у формулу
(2.8) вони входять подвійно). При невисоких температурах коливальні ступені вільності незбуджені і число ступенів вільності дорівнює:
i = 3– для одноатомних молекул; i = 5 – для двохатомних молекул;
i = 6 – для трьох (і вище) атомних молекул (тобто як і для твердого тіла).
13.4 Внутрішня енергія термодинамічної системи
– це енергія руху та взаємодії частинок, що складають систему: кінетична енергія теплового руху частинок, потенціальна енергія їх взаємодії, кінетична та потенціальнаенергія коливального руху атомів і молекул та внутрішньомолекулярна енергія. Внутрішня енергія є однозначною функцією стану системи. Зміна внутрішньої енергії ∆U при переході системи із початкового стану з енергією U1 до кінцевого стану з енергією U2 дорівнює ∆U=U2-U1 та не залежить від процесів, що призвели до переходу. Якщо система повертається до попереднього стану, внутрішня енергія її залишається незмінною. Внутрішню енергію системи можна змінити двома способами: виконанням над системою роботи A, або наданням їй кількості теплоти ΔQ.
13.6 Теплоємність
Теплоємністю тіла називають величину, яка дорівнює кількості теплоти, необхідної для збільшення температури тіла на один кельвін. У молекулярій фізиці здебільшого користуються поняттям теплоємності для одного моля газу. Для газів розрізняють два типи теплоємностей: при сталому об’ємі – CV і при сталому тиску – p C . Молярною теплоємністю називають величину, що дорівнює кількості теплоти, необхідної для збільшення температури 1 моля речовини на 1 К:
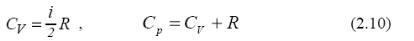
Із порівняння V C і p C випливає фізичний зміст сталої R: вона чисельно дорівнює роботі, яку виконує один моль газу при його нагріванні на один кельвін при ізобаричному процесі(p=const).
(13.8 Застосування першого закону термодинаміки до ізопроцесів та адіабатичного процесу ідеального газу.)
Адіабатний процес – це процес, який протікає без теплообміну газу із зовнішнім середовищем (тобто d Q=0). Якщо покласти d Q=0 у рівнянні першого закону термодинаміки
![]()
то отримаємо рівняння адіабати ідеального газу:

де g = Cp / CV = (i+2)/i, g – коефіцієнт адіабати, який визначається кількістю ступенів вільності i молекули.
13.7 Кількість теплоти - фізична величина, яка характеризує процеси обміну енергії між тілами.
