
- •2.Модели строения атома. Квантовые числа, атомные орбитали, энергия электронов.
- •3.Энергия ионизации, энергия сродства к е, электроотрицательность элементов.
- •4.Гибридизация атомных орбиталей.
- •5.Электронные структуры много электронных атомов. Правила Кличковского, правило Гунда, принцип Паули.
- •6. Периодический закон и периодическая система элементов.
- •7.Метод валентных связей и метод молекулярных орбиталей.
- •8.Основные виды хим.Связи. Характеристики хим.Связи (длина,энергия..)
- •9. Силы межмолекулярного взаимодействия. Водородная связь. Донорно-акцепторное взаимодействие.
- •10. Внутренняя энергия, энтальпия, энтропия.
- •11. Применение первого закона термодинамики к химическим реакциям. Закон Гесса и следствия из него.
- •12. Энергия Гиббса. Условия протекания физико-химических процессов.
- •13. Скорость химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ. Константа скорости.
- •Коррозия с водородной деполяризацией
- •34. Электролиз. Законы Фарадея. Электролиз расплавов.
- •35. Электролиз раствора солей.
- •36. Химическая идентификация. Качественный анализ.
- •37. Химическая идентификация. Количественный анализ.
- •38.Основные классы неорганических соединений.
- •39. Современные теории кислот и оснований. Буферные растворы.
Коррозия с водородной деполяризацией
на катодных участках – процесс восстановления ионов водорода.
Чаще всего этот процесс происходит в кислотах, включает 4 стадии:
Диффузия гидротированных ионов водорода катодным участком кородирующего металла.
Восстановление гидротированных ионов
Рекомбинация адсорбированных на металле атомов водорода.
Диффузия молекулярного водорода в глубь раствора.
Лимитирующая – 2 стадия.
К: 2H++2ѐ→H2
Fe+2HCl→FeCl2+H2
Скорость каждого процесса выделения водорода возрастает с повышением температуры и с понижением рН среды.
На скорость процесса существенно влияет природа катодных участков. Чем ниже перенапряжение выделения водорода, тем больше скоростью восстановления ионов водорода.
Задание: запишите электродные процессы, протекающие при коррозии слава (цинк, железо, олово) во влажной атмосфере. Укажите материал каждого участка.
ϕ (Zn)=-0,76B. На аноде - самый активный.
ϕ(Fe)=-0,44 B
ϕ(Sn)=-0,14B
ɳo2: Sn=0,Zn=0, Fe=0,3. На катоде тот, где величина перенапряжения наименьшая.
A(Zn): Zn - 2 ѐ→Zn2+
K(Sn, Zn): : O2+2H2O+4 ѐ→4OH-
Защита металлов от коррозии
Все методы защиты делятся на 5 основных групп
Легирование металла
Защитные покрытия
Электрохимическая защита
Изменение свойств коррозионной среды
Рациональное конструирование изделий.
Легирование метала – добавление спец компонентов , вызывающее пассивацию металла( наиболее широко – для защиты от газовой коррозии) (минус: дорогостоимость)
Защитные покрытия – искусственно создаваемые слои на поверхности металлических изделий.
А) металлические покрытия( катодные, анодные)
Б) неметаллические защитные покрытия(неорганические, органические)
Действие их сводится к изоляции металла от окружающей среды. Чаще всего в качестве неорганических покрытий используют эмали, оксиды металла, соединения хрома и фосфора. В качестве органических : лакокрасочные покрытия, смолами, пластмассами, полимерными пленками, резиной.
Электрохимическая защита. Метод основан на торможении анодных и катодных реакций коррозионного процесса.
Защищаемому изделию присоединяют протектор, который имеет более отрицательное значение электродного потенциала, или обладает большим значением поляризации.
Изменение свойств коррозионной среды основан на снижении агрессивности среды добавлением ингибиторов(спец компоненты, уменьшение скорости коррозионного процесса)
Рациональное конструирование исключает наличие, сокращают число и размеры особо подверженных коррозиям участков или предусматривают спец защиту этих участков.
34. Электролиз. Законы Фарадея. Электролиз расплавов.
Электролиз- это процесс,, протекающий на электродах при протекании электрического тока через раствор или расплав электролита.
Устройство провидения электролизам- электролизер состоит из двух электродов, один из которых присоединен к положительно заряженному аноду(окисление), второй в к отрицательно заряженному катоду (восстановление). ( у гальванического элемента наоборот к: «+» а: «-» )
При прохождении электрического тока через раствор или расплав электролита наблюда.тся следующие явления:
катионы движутся к катоду
анионы движутся к аноду
электрический ток проходит через раствор (расплав) за счет движения ионов
электроны от аниона переходят к аноду
электроны с катода переходят к катионам
На процесс электролиза большое влияние оказывает природа электродов (анода)
Аноды бывают: растворимые, нерастворимые (инертные – не реагирующие с окружающей средой; графит, платина, золото).
Растворимые электроды - соли окисляются в процессе электролиза и в виде ионов переходят в раствор электролита.
Таким образом на катоде при электролизе могут протекать следующие процессы:
восстановление ионов металла (расплавов)
восстановление молекул воды (H2O+2eH2 +2OH)
восстановление ионов водорода (только если электролит кислота pH<7)
На аноде:
1)окисление анода (в случае растворимого металла на аноде)
2)окисление галогенид ионов (Cl, F, Br, I)
3)окисление анионов кислородсодержащих кислот
4)окисление молекул воды
5)окисление гидроксид-ионов.
Если на одном и том же электроде возможно существование нескольких реакций, то предпочтительней оказывается та, для протекания которой требуется наименьшая ЭДС: на аноде протекает процесс наименьшим значением ᵠ0, а на катоде с наибольшим значением ᵠ0.
Электроды инертны.
Закон Фарадея
Масса вещества, выделившегося на электроде при прохождении по раствору электролита электрического тока, прямо пропорциональна количеству электричества.
Общая формула закона фарадея
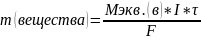
m(вещества) – масса выделившегося вещества
Mэкв. – малярная масса эквивалентов вещества
I – сила тока
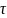 -
время протекания процесса
-
время протекания процесса
F- постоянная Фарадея
Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): Na+ + 1e = Na0
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
Точно так же
3) Неактивные металлы
Точно так же
