
- •2.Модели строения атома. Квантовые числа, атомные орбитали, энергия электронов.
- •3.Энергия ионизации, энергия сродства к е, электроотрицательность элементов.
- •4.Гибридизация атомных орбиталей.
- •5.Электронные структуры много электронных атомов. Правила Кличковского, правило Гунда, принцип Паули.
- •6. Периодический закон и периодическая система элементов.
- •7.Метод валентных связей и метод молекулярных орбиталей.
- •8.Основные виды хим.Связи. Характеристики хим.Связи (длина,энергия..)
- •9. Силы межмолекулярного взаимодействия. Водородная связь. Донорно-акцепторное взаимодействие.
- •10. Внутренняя энергия, энтальпия, энтропия.
- •11. Применение первого закона термодинамики к химическим реакциям. Закон Гесса и следствия из него.
- •12. Энергия Гиббса. Условия протекания физико-химических процессов.
- •13. Скорость химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ. Константа скорости.
- •Коррозия с водородной деполяризацией
- •34. Электролиз. Законы Фарадея. Электролиз расплавов.
- •35. Электролиз раствора солей.
- •36. Химическая идентификация. Качественный анализ.
- •37. Химическая идентификация. Количественный анализ.
- •38.Основные классы неорганических соединений.
- •39. Современные теории кислот и оснований. Буферные растворы.
4.Гибридизация атомных орбиталей.
Гибридизация- процесс смещения разн. (s,p,d) орбиталей центральн.атома многоатомн.молекулы с возникновением того же числа орбиталей,эквивалентным по своим характеристикам.
Виды: (sp)-гибридиз.= 2 гибрид.орбитали:смешивание 1ой s- p-орбит.: 2 равноценные sp атомные орбитали,распол.линейно под углом 180. 2 отавшиеся негибридные р-орб.расположены во взаимно перпендикулярных плоскостях и участв.в образовании π-связей заним.неопределен. параметр.е.
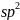 -
1s+2p
орб.:3 гибридн.орб. с осями распол.в1ой α
пл-ти и направл.к вершинам треугольника
под углом 120. Негибридн.α ор-ль перпенд.пл-ти
учавствовавш.в образовании π св-и.
-
1s+2p
орб.:3 гибридн.орб. с осями распол.в1ой α
пл-ти и направл.к вершинам треугольника
под углом 120. Негибридн.α ор-ль перпенд.пл-ти
учавствовавш.в образовании π св-и.
 -1s+3p
орб.:4
гибр.орбит.
могут образовывать 4 σ св-и.с другими
атомами.
-1s+3p
орб.:4
гибр.орбит.
могут образовывать 4 σ св-и.с другими
атомами.
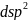 =
4 гибр.орбитали
=
4 гибр.орбитали
d = 4 гибр.орб.(плоскоквадратные)
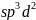 =
6 (октаэндрич.)
=
6 (октаэндрич.)
5.Электронные структуры много электронных атомов. Правила Кличковского, правило Гунда, принцип Паули.
Электронные структуры много электронных атомов:
2 е не могу иметь одинаковые все 4 квант.числа. это заменяется принципом Паули: В атоме состояние любых 2х е должны различаться хотябы одним из 4х кван.чисел.
Согласно принципу Паули можно найти max число е на орбитале, подуровне и уровне.Max число е на подуровне будет определяться след.формулой: 2(l+1). Max число е на уровне опред.ф-лой 2n2 ,где n номер уровня.
Состояние е,характеризуемое определенной величиной энергии называют энергетич.состоянием. Переход из одного состоян.в другое связано со скачком принимаемой энергии.
Изменение энергии в е в много электрон.атоме в зависимости от суммы (n+l) определяется правилами Клечковского:
1)Энергия атомное орбитали ↑ в порядке возрастания суммы (n+l)
2)При одинаковых значениях суммы (n+l) энергия атомной орбитали ↑ лишь в порядке ↑ главн.квантового числа (n)
Заполнение атомных орбиталей е в атомах эл-тах происходит в такой же послед-ти,т.е.соблюдается принцип наименьшей энергии.
Правило Гунда:
В атоме с min запасом энергии е распределяются в пределах подуровня таким образом,чтобы суммарный спин был max.
6. Периодический закон и периодическая система элементов.
В основе переодич.системы лежит период.закон: сво-ва простых в-ств а так же форма и сво-ва их соединений находятся в периодич.зависимости от заряда ядра атома.
ПС состоит из 8 период и 7 групп.
Период-горизонт.ряда эл-тов с одинаковым макс значением главного квантового числа.Номер периода шнгропоказывает на число энергет.уровней.
Периоды могут состоять из 2,8,18,32 эл-тов.
Все периоды кроме 1ого начинаются щелочным Ме и заканчиваются благородным газом. Большие периоды делятся на ряды.Ряды бывают четными и нечетными.
Группы- вертикальные столбцы элементов с одинаковым числом валентных е.
Различают главные и побочные подгруппы. Главные состоят из эл-в s и p семейств,побочные из d и f.
Семейство хим.эл-та определ.под уровнем,который заполняется вал.е.
Эл-ты главных и побочных подгрупп сильно различаются друг от друга по св-вам.
Все св-ва эл-тов определяемые электронной структурой изменяются по периодам и подгруппам.
