
- •2.Модели строения атома. Квантовые числа, атомные орбитали, энергия электронов.
- •3.Энергия ионизации, энергия сродства к е, электроотрицательность элементов.
- •4.Гибридизация атомных орбиталей.
- •5.Электронные структуры много электронных атомов. Правила Кличковского, правило Гунда, принцип Паули.
- •6. Периодический закон и периодическая система элементов.
- •7.Метод валентных связей и метод молекулярных орбиталей.
- •8.Основные виды хим.Связи. Характеристики хим.Связи (длина,энергия..)
- •9. Силы межмолекулярного взаимодействия. Водородная связь. Донорно-акцепторное взаимодействие.
- •10. Внутренняя энергия, энтальпия, энтропия.
- •11. Применение первого закона термодинамики к химическим реакциям. Закон Гесса и следствия из него.
- •12. Энергия Гиббса. Условия протекания физико-химических процессов.
- •13. Скорость химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ. Константа скорости.
- •Коррозия с водородной деполяризацией
- •34. Электролиз. Законы Фарадея. Электролиз расплавов.
- •35. Электролиз раствора солей.
- •36. Химическая идентификация. Качественный анализ.
- •37. Химическая идентификация. Количественный анализ.
- •38.Основные классы неорганических соединений.
- •39. Современные теории кислот и оснований. Буферные растворы.
12. Энергия Гиббса. Условия протекания физико-химических процессов.
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции.
Классическим определением энергии Гиббса является выражение
![]() или
через энтальпийный и энтропийный
факторы.
или
через энтальпийный и энтропийный
факторы.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса.
Если изменение энергии Гиббса больше нуля, то самопроизвольно протекает обратный процесс, если меньше нуля, то протекает прямая реакция, равно нулю-химическое равновесие.
Условия протекания физико-химических процессов
∆G ›0 – то протекает обратный процесс(самопроизвольный)
∆G ‹ 0- реакция возможна при любой температуре
∆G= 0 – то система находится в хим.равновесии(скор.прямой=скор.обрат.)
13. Скорость химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ. Константа скорости.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Для линейной зависимости средняя скорость есть величина постоянная и определяется тангенсом угла наклона к оси времени. Для нелинейной, грубое приближение.
Факторы, влияющие на скорость: концентрация реагирующих в-в, природа, температура, наличие катализатора (ингибитора).
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Билет 22.растворы электролитов.диссоциация кислот,оснований, солей
1.процесс растворения связан с диффузией(самопроизвольным распределением частиц одного вещ-ва между частицами другого)
2.при внесении растворимого вещества в раст-ль процесс идет самопроизвольно и раствор остается ненасыщенным.при ▲G=0 р-р становится насыщенным.
3.можно получить перенасыщенный раствор.он представляет собой систему находящуюся в кажущемся равновесии. растворимость вещ-ва = его концентрация в насыщенном р-ре.
4.абсолютно нерастворимых в-в нет.
5.электролиты-вещ-ва,растворы или расплавы которых проводят ток.
6.теория электролитической диссоциации
6.1.т.Аррениуса:
Все эл-ты в р-рах диссоциируют на ионы. проводимость вызвана движением ионов.р-р электронейтрален. ионы движутся независимо друг от друга. диссоциация-процесс обратимый(ассоциация).причина дис-ии – движение молекул р-го вещ-ва.в водных р-ах содержатся гидротированные ионы.
7.в молекулах эл-тов должны быть тока ков-поялрные или ионные связи.
8.в обратном случае дис-ия не идет.
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо.
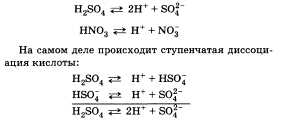

Билет № 23
Сила электролитов
10.1. слабые (0-3 %) все нер-ые осн-ия,орг-ие кислоты,сероводороднвя к-та,угольная(крому МУР-ой и уксусной).
10.2.средние(3-30%) :HF\H2SO3\H3PO4/муравьиная , щавельная.
10.3. сильные(>30%)
Nh4OH--->NH4 + OH
K(c)=(NH4)(OH)/(NH4OH)=K(NH4OH)-константа дис-ии, не зависит от C р-ра, но зав-ит от T(темп)\природы.(nh4)=альфа*С(NH4OH)
Кд(NH4OH)=α^2 *С(NH4OH)/(1-α),для слабых электролитов(1-альфа)=1
α =корень(Кд\С),С-конц-ия,Кд-конст дис-ии….это и есть закон разбавления Оствальда…при добавлении в р-р одноименного иона,хим.равновес.смещается в сторону ассоциации.
Диссоциация многоосновной (борной) кислоты:
I стадия: H3BO3 ↔ H + H2BO3,
II стадия: H2BO3− ↔ H + HBO3,
III стадия: HBO3 ↔ H + BO3,
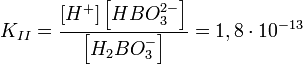
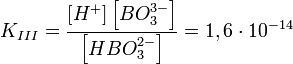
дис-ия хар-ся сепенью дис-ии: альфа=число молекул распавшихся на ионы делить на общее число молекул.при увел-ии t –ув-ся альфа, при ув-ии конц-ии р-ра-уменьшаеца.степень зависит от природы эл-та.
Билет24.
Твердые вещ-ва хар-ся разной растворимостью.любое вещ-во обладает растворимостью.PbCL2Pb + 2Cl
ПР=(Pb)(Cl)^2…хлор в квадрате
ПР-произведение концентраций ионов малорастворимого вещ-ва при постоянной температуре есть величина постоянная,зависит от природыв вещ-ва.
Условие выпадения осадка: ПК>ПР,ПК-произведение концентраций( ПК=(kat)(An) )
Условие растворения осадков: ПК<ПР
27. Возникновение двойного электрического слоя на границе металл-раствора. Уравнение Нернста. Потенциалы металлических, газовых и окислительно-восстановительных электродов.
28. Гальванический элемент. Условие работы. Расчет ЭДС. Кинетика электродных процессов. Поляризация.
Гэ – устройство, вырабатывающее электрический ток в результате протекания ОВР. Токообразующие реакции.
2 электрода, опущенных в раствор собственных солей; р-ры разделены пористой перегородкой или электролитическим мостиком; электроды замкнуты во внешнюю цепь с помощью металлического проводника, разомкнутый гэ может находиться в заторможенном неравновесном состоянии неопределенно долго. Электроды: анод, катод.
Анод – более активные металл, имеющий наименьшее значение потенциала, заряжен отрицательно. На аноде всегда протекает процесс окисления, на катоде – восстановления.
А: Mg-2e – Mg2+
K: Ni2++2e – Ni
Суммарное уре работы гэ: Mg0+Ni2+ - Mg2++Ni
Схема гэ: (A)Mg I Mg2+ II Ni2+ I Ni(К)
(MgCl2)(NiCl2)
(1M MgCl2)(2M NiCl2)
Необходимым условием работы гэ является разность потенциалов электродов – электродвижущая сила – ЭДС=ε0=ϕ0к-ϕ0а (при стандартных условиях)
Гэ работает в том случае, если ЭДС>0.
ε0 =-ΔG0р-ции/nF где n – число электронов, участвующих в процессе. F - константа Фарадея.
ϕ0окислителя>ϕ0восстановителя
В реальных условиях для расчета электродных потенциалов используется уре Нернста:
ϕ = ϕ0 +(RT/nF )* ln (αок-ля/ αв-ля ) где α – активность ионов
ϕ = ϕ0 +(0,059/nF )* lg (αок-ля/ αв-ля ) концентрации для расчетов
типы электродов:
1,2) Металлические электроды первого и второго рода
3) газовые электроды
4) окислительно-восстановительные электроды
Металлические электроды 1 рода представляют собой металл, погруженные в раствор собственной соли. Me|Men+
Me↔ Men+ +nѐ
Уравнение Нернста: ϕMe/ Men+= ϕMe/ Men++ (0,059/n)lg αMen+ (αMen+ концентрация раствора)
Стандартные электродный потенциал в растворе собственных ионов с их α=1 и измеренный при стандартных условиях.
Металл, расположенный в порядке возрастания их стандартных электродных потенциалов образуют электрохимический ряд напряжения металлов. Чем меньше значение потенциала, тем сильнее восстановительные свойства металлов.
Металлические электроды 2 рода представляют собой металл, покрытый своей нерастворимой солью, опущенной в раствор соли, имеющий одинаковый анион с нерастворимой солью металла.
Ag,AgCl | KCl
Газовые электроды состоят из металлического электрода, контактирующего одновременно с газом и раствором, содержащим ионы этого газа.
Металлический электрод должен быть инертным(чаще платина).
Наиб известные газовые электроды: водородный и кислородный.
Водородный
Pt, H2 | 2H+
2H+ + 2ѐ↔H2
ϕ2H+/ H2=0 В
Уравнение Нернста: ϕ2H+/ H2 = ϕ02H+/ H2 +(0,059/2 )* lg (α22H+/ αH2 )
Кислородный
O2+2H2O+ 4ѐ↔4OH-
Pt, O2 |OH-
Окислительно-восстановительно электрод представляет собой инертный электрод, опущенный в рр электролита, содержащего окисленную и восстановленную форму вещества.
Pt|Ox, Red(Ox-окисленная форма, Red-восстановленная форма)
Pt | Sn2+, Sn 4+
Sn2+-2 ѐ ↔ Sn 4+
Red Ox
ϕ Sn2+/ Sn4+ = ϕ0Sn2+/ Sn4+ +(0,059/2 )* lg (αSn4+/ αSn2+ )
Кинетика электронных процессов.
Равновесные потенциалы электродов могут быть определены в условиях отсутствия тока.
При прохождении электрического тока потенциал электродов изменяется.
Изменение электродных потенциалов при прохождении электрического тока – поляризация. Δϕ=ϕi - ϕp (ϕi - при прохождении тока. ϕp – равновесный) .
поляризация - следствие отставания процессов окисления на аноде и восстановления на катоде от процесса перехода электронов во внешней цепи.
(К) или (А) – поляризация разная.
При прохождении электрического тока ϕ(К) уменьшается, ϕ(А) увеличивается.
Величины поляризации характеризуют торможение анодного и катодного процессов.
Скорость и механизм протекания электродных процессов изучает электрохимическая кинетика.
Каждая электрохимическая реакция протекает минимум в 3 стадии:
подвод реагентов к электроду
собственная электрохимическая реакция
отвод продуктов реакции от электрода
если бы все стадии протекали мгновенно, то потенциал = 0. Но как правило одна из стадии лимитирующая в зависимости от стадии выделяют два типа потенциала:
концентрационная. Обусловлена 1 и 3 стадией реакции(чаще первой).понижение потенциала: перемешивание раствора
электрохимический потенциал (2 стадия)
Δϕ→перенапряжение→ɳ
наиболее значимо для газовых электродов .
зависит от : материал электрода.
коррозия металлов и защита от коррозии.
Коррозия – разрушение металла в результате взаимодействия с окружающей средой.
По механизму процесса – 2 вида коррозии: химическая, электрохимическая.
Химическая характерная для сред, не проводящих электрический ток.
Представляют собой самопроизвольное разрушение металла в среде окислительного газа при повышенных температурах или в жидких не электролитов.
Механизм представляет собой обычную ОВР , в которой электроны непосредственно от металла переходят к окислителю.
nMe + m/2 O2↔Men Om
Выделяют несколько стадий химической коррозии:
адсорбция (поглощение газообразного вещества твердым) газа (кислород) поверхностью металла при наличии сродства между металлом и кислородом адсорбция переходит в химическое взаимодействие с образование оксидных пленок. Образование пленок приводит к самоторможению коррозионного процесса, если продукты коррозии обладают защитными свойствами.
Защитными свойствами только сплошные пленки.
Условие сплошности: объем продуктов коррозии должен быть больше, чем объем металла, израсходованного на образование моля оксида. Если V Men Om /VMe меньше 1, то образующая пленка не может быть сплошной и не защищает металл от коррозии. Скорость роста пленки у таких металов постоянна во времени. Если V продуктов коррозии /VMe больше1 , то образующая пленка является сплошной, процесс коррозии будет тормозится диффузией реагентов через пленку и по мере утолщения пленки скорость коррозии будет уменьшаться, процесс коррозии тоже.
V Men Om /vMe=(Mоксида*ρMe)/(n*MMe*ρоксида) (n – число атомов металла в молекуле оксида, ρ =г/см3, V= см3)
Достаточно хорошими защитными свойствами будут обладать металлы, 2,5> V Men Om /vMе>1.
У пленок со значением больше 2,5 могут возникать внутреннее напряжения, приводящее к разрушению пленки(трещинам).
Оксидные пленки:
Тонкие: толщина до 40 нм (не видны).
Средние: 40-50нм(перламутровые).
Толстые: более 50нм.
Вывод: скорость химической коррозии будет зависеть от свойства защитной пленки( природы металла, окислителя) от температура( чем темп больше, тем скорость коррозии больше. резкие перепады темп – трещины.).
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость.
Представляют собой самопроизвольное разрушение металла в средах, проводящих элток.
Процесс взаимодействия металла с окислителем включает в себя анодное растворение металла и катодное восстановление окислителя.
В электролитах, почве, где влага.
По механизму протекания электрохимическая коррозия значительно отличается от химической и напоминает работу гэ.
Обязательное условие протекания электрохимической коррозии : пространственное распределение анодных и катодных участков.
Условием протекания коррозии как и в любом гэ будет: ϕ0окислителя>ϕ0восстановителя
Причиной электрохимической коррозии является наличие в окружающей среде окислителя с более положительным электронным потенциалом, чем потенциал металла.
Потенциал окислителя зависит от условий.
на анодных участках всегда протекает процесс окисления металла
А: Me - n ѐ →Men+
На катодных – процесс восстановления окислителя.
При коррозии молекула окислителя могут быть : молекулы кислорода, хлора, ионы водорода, нитрат ионы.
процесс коррозии металла с кислородной диполяризацией.
На катодных участках происходит процесс восстановления кислорода, растворенного в элите. Каждый процесс включает в себя 4 стадии.
Растворение кислорода воздуха в элите
Диффузия молекул растворенного кислорода к катодным участкам кородирующего ме
Восстановление молекул кислорода.
рН≥7 К: O2+2H2O+4 ѐ→4OH (атмосфера, нейтральная, щелочная среда)
рН<7 К: O2+4H++4 ѐ→2H2О (кислая среда, почва)
Диффузия и перенос продуктов восстановления в глубь раствора.
Чаще всего лимитирующая стадия – 2.
Условие: ϕMen+/Me<ϕ O2+2H2O/4OH
Задача: Какие процессы протекают при атмосферной коррозии железа и как расположены катодные и анодные участки.
ϕFe2+/Fe=-0,44 B ϕ O2+2H2O/4OH =0,805 В (-0,44 B < 0,805 В → процесс протекает)
А: Fe - 2ѐ→Fe2+
К: O2+2H2O+4 ѐ→4OH-
Суммарный процесс коррозии: 2Fe +O2+2H2O→2Fe(OH)2 (не ржавчина)
