
- •2.Модели строения атома. Квантовые числа, атомные орбитали, энергия электронов.
- •3.Энергия ионизации, энергия сродства к е, электроотрицательность элементов.
- •4.Гибридизация атомных орбиталей.
- •5.Электронные структуры много электронных атомов. Правила Кличковского, правило Гунда, принцип Паули.
- •6. Периодический закон и периодическая система элементов.
- •7.Метод валентных связей и метод молекулярных орбиталей.
- •8.Основные виды хим.Связи. Характеристики хим.Связи (длина,энергия..)
- •9. Силы межмолекулярного взаимодействия. Водородная связь. Донорно-акцепторное взаимодействие.
- •10. Внутренняя энергия, энтальпия, энтропия.
- •11. Применение первого закона термодинамики к химическим реакциям. Закон Гесса и следствия из него.
- •12. Энергия Гиббса. Условия протекания физико-химических процессов.
- •13. Скорость химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ. Константа скорости.
- •Коррозия с водородной деполяризацией
- •34. Электролиз. Законы Фарадея. Электролиз расплавов.
- •35. Электролиз раствора солей.
- •36. Химическая идентификация. Качественный анализ.
- •37. Химическая идентификация. Количественный анализ.
- •38.Основные классы неорганических соединений.
- •39. Современные теории кислот и оснований. Буферные растворы.
7.Метод валентных связей и метод молекулярных орбиталей.
1.Метод вал.связей. Основные положения:
1)Причиной связей является электростатическое вз-вие ядер и е.
2)хим связь между атомами возникает как результат перекрывания атомных орбиталей с образован. Общей элетронной пары.
3)в соответствии с принципом Паули,хим.связь образуется лишь при вз-ии е с противоположными спинами.
4)хар-ки хим. связи опред.типами перекрываниями атомных орбиталей.
Метод молек.орбиталей:объясняет св-ва молекул.
Причиной
связи является
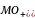 =
=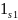 +
+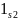 /
/
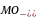 =
-
=
-
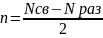
8.Основные виды хим.Связи. Характеристики хим.Связи (длина,энергия..)
Хим.связь-вз-вие атомов,обуславливающие их соединения в молекулы и кристаллы,действующие при образовании хим.связи силы имеют в основном электростатическую природу.
Виды хим. св-зи:
1)ковалентная-возникает между атомами в результате обобществления неспаренных е,принадлежащих разным атомам. Каждая из пар,образуют только 1 ковалентную связь. Она является двух электронной,двух центровой связью.Д/существования молекулы (Fпритяж=Fотталкив). Если ков.св.возникает между атомами с одинак. Электроотрицательностями,то общая пара раполаг.симметрично между ядрами обоих атомов, то это ковал.неполярная связь.
1.Ковалентная полярная связь-если разность ЭО попадает в (0до2)
Св-ва ковал.св.
1)насыщаемость (св-во атома образует огромное кол-во ковал.связей).Следствием насыщаемости явл.строго определенный состав молекулы. Число возм.ков.св.определяется ковалентностью атома хэ.
2) Есв.-кол-во Е,выдел.при образов-нии св.
3)l(длина) связи-расстояние между ядрами атомов,образов.хим.св. Чем больше радиус орбитали тем меньше электронная плотность и прочность св.
4)направленность(ков.св. возникает в направлении макс перекрывания облаков взаимод.атомов. В пространстве элекронные облака располагается под определенным углом).
5)кратность(если
св.между двумя атомами осуществ.не m
1ой, а несколькими
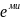 парами,то образ.многократные св.)
парами,то образ.многократные св.)
6)поляризуемость(способность молекулы становиться полярной)
2.Ионная
св.-частн.случай ковал.связи,когда
образуется
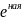 пара полностью принадл.более электро
отрицательному атому.
пара полностью принадл.более электро
отрицательному атому.
Обусловлена притяжением + и – ионов.
Na-е→катион(+ заряд)
Вз-вие ионов противопол.знака не зависят от направления,не облад.св-вом насыщенности.
В ион.кристал.решетки нет молекул. Координацион.число ионов-каждый ион окружен определ.числом иснов др.знака.
3.Металлическая связь-возникает в результате частичной делокализации валент.е,кот.достаточно свободно движется в решетке металлов. Является промежуточн.между ковал.и ионной св.Не локализована и не направлена. С ков.св.роднит то, что е находится во взаимном пользовании,но не у 2х атомов, а у всех с ион.св.-то, что атомы удерж.в соединении электростатич.силы притяжения.
9. Силы межмолекулярного взаимодействия. Водородная связь. Донорно-акцепторное взаимодействие.
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтены Я. Д. Ван-дер-Ваальсом в 1873 году. Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей. ???
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
взаимодействие, донорно-акцепторное иначе донорно-акцепторная связь; координационная связь; пернос заряда (англ. donor-acceptor interaction, coordination bond, charge transfer) — взаимодействие, основанное на переносе заряда или передаче пары электронов от донора к акцептору. донор (англ. donor) — (от лат. dono — дарю) — атом или молекула, отдающая акцептору электрон или электронную пару.
Донорно-акцептороное взаимодействие включает случаи переноса заряда между молекулами донора и акцептора без образования между ними химической связи и передачи неподеленной электронной пары от донора к акцептору, приводящей к образованию связи.
