
- •1. Перенос энергии электромагнитной волной, вектор Пойтинга, интенсивность. Шкала электромагнитных волн.
- •2. Основные законы геометрической оптики. Принцип Ферма. Оптический путь. Принцип Гюйгенса.
- •3. Интерференция и когерентность. Интерференция от двух точечных излучателей на примере опыта Юнга.
- •4.Интерференция по методу деления волнового фронта: бипризма Френеля, зеркало Ллойда.
- •5.Интерференция света в плоскопараллельных пластинах. Линии равного наклона и равной толщины.
- •6. Принцип Гюйгенса-Френеля. Зоны Френеля. Метод векторных диаграмм.
- •7.Дифракция Френеля от простейших преград. Зонная пластинка.
- •Дифракция от диска
- •8. Дифракция Фраунгофера от щели (случай нормального падения света). Расчет интенсивности методом векторных диаграмм.
- •9. Количественный критерий вида дифракции.
- •10. Дифракция Фраунгофера на решетке (случай нормального падения света).
- •11.Дифракционная решетка как спектральный прибор: угловая дисперсия, разрешающая сила, критерий Рэлея.
- •12.Поляризация света. Виды поляризации. Закон Малюса.
- •Вопрос 13. Поляризация света при отражении и преломлении. Закон Брюстера.
- •14. Дисперсия света. Фазовая и групповая скорости.
- •15. Абсолютно черное тело. Законы излучения.
- •Закон Кирхгофа.
- •Закон Стефана-Больцмана.
- •Закон смещения Вина.
- •16. Тепловое излучение. Закон Кирхгофа.
- •19. Тормозное рентгеновское излучение.
- •20. Фотоэлектрический эффект.
- •21. Рассеяние рентгеновских лучей. Эффект Комптона.
- •22. Модель атома Резерфорда. Опыты по рассеиванию α-частиц.
- •23. Закономерности в атомных спектрах. Формула Бальмера.
- •24. Постулаты Бора. Правило квантования орбит.
- •25. Элементарная боровская теория водородного атома.
- •26.Волновые свойства микрочастиц. Гипотеза Луи де Бройля.
- •27.Соотношение неопределенностей Гейзенберга.
- •28. Свойства волновой функции. Принцип суперпозиции.
- •29. Уравнение Шредингера. Квантование энергии частиц.
- •Вопрос 30. Частица в потенциальной яме.
- •31.Атома водорода. Квантовые числа.
- •33. Металлы, диэлектрики и полупроводники с точки зрения зонной теории.
22. Модель атома Резерфорда. Опыты по рассеиванию α-частиц.
-
Любой атом состоит из положительно заряженного ядра и окружающей его электронной оболочки.
-
Размеры ядра менее
 см., размеры самого атома около
см., размеры самого атома около
 см.
см.
-
Практически вся масса атома сосредоточена в ядре.
Экспериментальное доказательство изложенной модели атома было дано Резерфордом с помощью рассеяния α-частиц (ядер атомов He) тонкой металлической фольгой.
Было
обнаружено, что подавляющее число
α-частиц рассеивалось на небольшие углы
(менее 3 градусов), но и наблюдались
отдельные α-частицы, рассеянные на
большие углы (> ).
Такие частицы появлялись в результате
единичного акта их взаимодействия с
ядрами атома.
).
Такие частицы появлялись в результате
единичного акта их взаимодействия с
ядрами атома.
Взаимодействие указанных α-частиц с ядром является кулоновским, а заряд и масса ядра локализованы в очень малой области атома. Исходя из этого, Резерфорд вывел формулу для распределения рассеянных α-частиц в зависимости от угла отклонения θ. Принималось во внимание рассеяние α-частиц только на ядрах, так как заметного отклонения α-частиц электронами не может быть – масса электронов на четыре порядка меньше массы α-частиц.
Когда α-частица пролетает вблизи ядра, её траектория представляет собой гиперболу, угол отклонения θ α-частицы равен углу между асимптотами гиперболы.

q
и
 - заряды налетающей частицы и ядра; b
– прицельный параметр, то есть расстояние
от ядра до первоначального направления
движения налетающей частицы, когда она
находится вдали от ядра; K
– кинетическая энергия частицы вдали
от ядра.
- заряды налетающей частицы и ядра; b
– прицельный параметр, то есть расстояние
от ядра до первоначального направления
движения налетающей частицы, когда она
находится вдали от ядра; K
– кинетическая энергия частицы вдали
от ядра.
23. Закономерности в атомных спектрах. Формула Бальмера.
Спектры, состоящие из отдельных узких спектральных линий, и обусловленные излучением невзаимодействующих друг с другом атомов, называются линейчатыми.
Спектральные линии расположены не беспорядочно, а образуют серии линий. Изучая линейчатый спектр атомарного водорода, Бальмер установил следующую закономерность:
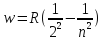 ,
n=3,4,5,…
,
n=3,4,5,…
w
– циклическая частота, соответствующая
каждой спектральной линии; R=2,07*
 – постоянная Ридберга. Дальнейшие
исследования спектра атомарного водорода
показали, что имеется ещё несколько
серий.
– постоянная Ридберга. Дальнейшие
исследования спектра атомарного водорода
показали, что имеется ещё несколько
серий.
 ,
n=2,3,4,… - серия Лаймана;
,
n=2,3,4,… - серия Лаймана;
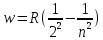 ,
n=3,4,5,… - серия Бальмера;
,
n=3,4,5,… - серия Бальмера;
 ,
n=4,5,6,… - серия Пашена;
,
n=4,5,6,… - серия Пашена;
 ,
n=5,6,7,… - серия Брэкета;
,
n=5,6,7,… - серия Брэкета;
 ,
n=6,7,8,… - серия Пфунда.
,
n=6,7,8,… - серия Пфунда.
Все эти серии можно представить в виде обобщённой формулы Бальмера:
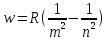
С
ростом n частота линий в
каждой серии стремится к предельному
значению
 ,
которое называют границей серии. За
границей серии спектр не обрывается, а
становится сплошным.
,
которое называют границей серии. За
границей серии спектр не обрывается, а
становится сплошным.
24. Постулаты Бора. Правило квантования орбит.
Постулаты Бора:
1. Электрон в атоме может двигаться только по некоторым дискретным орбитам, удовлетворяющим определённым условиям квантования. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитным волн (света).
2. Излучение испускается или поглощается в виде светового кванта энергии при переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона.

Правило квантования орбит:
Электрон в атоме движется только по тем круговым орбитам, для которых его момент импульса равен постоянной Планка.
 ,
n=1,2,3,…
,
n=1,2,3,…
n – номер орбиты, главное квантовое число.
