
- •1. Сериальные закономерности атомных спектров.
- •19. Влияние межмолекулярных взаимодействий на спектр молекулы.
- •2. Тонкое расщепление атомных спектров. Спин-орбитальное взаимодействие.
- •17. Классификация электронных переходов в молекулах, соотношения между интенсивностями спектральных линий различных типов переходов.
- •3. Систематика спектров многоэлектронных атомов.
- •10. Колебательно-вращательные спектры двухатомных молекул.
- •5. Особенности спектральных термов в приближении “j-j” связи.
- •6. Общая характеристика спектров молекул.
- •7. Вращательные спектры двухатомных молекул в приближении жёсткого ротатора.
- •11. Колебательно-вращательные спектры многоатомных молекул.
- •12. Связь между характером колебаний и интенсивностью колебательных полос поглощения.
- •13. Классификация нормальных колебаний по форме и симметрии молекул.
- •16. Вероятность электронно-колебательных переходов.
- •8. Вращательные спектры многоатомных молекул.
- •18. Методы описания межмолекулярных взаимодействий.
- •20. Изменения спектров поглощения и люминесценции растворов по сравнению со спектрами газов. Принцип Франка-Кондона для межмолекулярных взаимодействий.
- •4. Особенности спектральных термов в приближении “l-s” связи.
- •9. Колебательные спектры двухатомных молекул
- •14. Спектры комбинационного рассеяния молекул
- •15. Электронные состояния двухатомных молекул.
1. Сериальные закономерности атомных спектров.
Атомам каждого вещества присущ определенный вид спектра. Все атомные спектры линейны и не зависят от способа возбуждения вещества. Обычно отдельные линии в спектре могут быть объединены в серии.
Спектральной серией называется совокупность спектральных линий, соответствующих переходам с одного и того же энергетического уровня спектра поглощения или на один и тот же уровень спектра испускания.
Каждое
состояние электрона в атоме водорода
можно охарактеризовать тремя квантовыми
числами: n – главное квантовое число,
определяющее энергию состояния, может
принимать любые значения, начиная с
единицы; l – орбитальное квантовое
число, определяющее значение орбитального
момента количества движения ( );
m – магнитное квантовое число, определяющее
проекцию орбитального момента импульса
на выбранное направление (m = -l,…0,…l,
всего 2l+1 значение).
);
m – магнитное квантовое число, определяющее
проекцию орбитального момента импульса
на выбранное направление (m = -l,…0,…l,
всего 2l+1 значение).
Энергия
атома в состоянии (n,l,m) однозначно
определяется значением n в кулоновском
поле и не зависит от квантовых чисел l
и m до тех пор, пока не учитываем
спин-орбитальное взаимодействие,
следовательно, для частицы в кулоновском
поле характерно
 - кратное вырождение уровней.
- кратное вырождение уровней.
В спектроскопии принято обозначение состояния электрона по значению орбитального квантового числа малыми латинскими буквами: l = 0 – s-состояние, l = 1 – p-состояние, l = 2 – d, l=3 – f, l = 4 – g, l = 5 – h.
Между состояниями с квантовыми числами (n,l,m) и (n’,l’,m’) возможны переходы. Если переход сопровождается излучением фотона, то такой переход называется радиационным или излучательным. Для радиационных переходов выполняется правило отбора: ∆l = l’ – l = ±1, ∆m = m’ – m = 0, ±1.
Переходы, для которых выполняется правило отбора, называются разрешенными.
В спектре излучения атома водорода отчетливо наблюдаются спектральные серии.
[1/λ]
= [ ],
1/λ = R(1/
],
1/λ = R(1/ - 1/
- 1/ ),
n = 2,3,4… - серия Лаймана. R = 109677,581
),
n = 2,3,4… - серия Лаймана. R = 109677,581
 .
.
В
серии Лаймана отчетливо наблюдаются
линии
 .
.
1/λ
= R(1/ - 1/
- 1/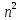 ),
n = 3,4,5… - серия Бальмера. Линии
),
n = 3,4,5… - серия Бальмера. Линии
 .
.
1/λ
= R(1/ - 1/
- 1/ ),
n = 4,5,6… - серия Пашена
),
n = 4,5,6… - серия Пашена
1/λ
= R(1/ - 1/
- 1/ ),
n = 5,6,7… - серия Брэккета
),
n = 5,6,7… - серия Брэккета
1/λ
= R(1/ - 1/
- 1/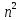 ),
n = 6,7,8… - серия Пфунда
),
n = 6,7,8… - серия Пфунда
Для любых двух уровней с квантовыми числами n и n' существуют состояния, между которыми возможны радиационные переходы.
В спектре излучения любого атома выделяют и часто используют резонансную линию – линию, соответствующую переходу из основного состояния в первое возбужденное в спектре поглощения и наоборот в спектре испускания.
Резонансной
линией водорода является главная линия
серии Лаймана
 ,
соответствующая переходу из n = 1 в n = 2
(
,
соответствующая переходу из n = 1 в n = 2
( ).
Основными линиями ближнего УФ – спектра
являются линии серии Бальмера:
).
Основными линиями ближнего УФ – спектра
являются линии серии Бальмера:
 .
.
-----------------------------------------------------------
19. Влияние межмолекулярных взаимодействий на спектр молекулы.
Переход молекулы из газовой фазы в конденсирующую среду (жидкость, т.т, раствор) приводит к изменению характерного спектра. Это изменение выражается:
- в сдвиге полос в спектрах поглощения, испускания, рассеяния;
- в изменении их интенсивности;
- в изменении формы (ширины и симметрии) полос;
- в изменении поляризации полос;
- в появлении новых полос, исчезновении полос.
Изменение спектров определяется как свойствами самой исследуемой молекулы, так и природой растворителя. Часто полоса смещается на 10-80 %. Установлены общие закономерности, касающиеся спектроскопических проявлений межмолекулярных сил. Их особенностью является то, что в системе межмолекулярных взаимодействий источником информации о свойствах веществ служит не спектр молекулы, а изменение ее спектра под влиянием межмолекулярных сил. Межмолекулярные взаимодействия принято разделять на универсальные и специфические.
Универсальные взаимодействия – взаимодействия окружающего молекулу континиума других молекул без перекрывания электронных оболочек. Главную роль в них играет дальнодействующее взаимодействие, а именно электростатическое и ван-дер-ваальсовое. Для электрически нейтральной молекулярной системы в универсальных взаимодействиях преобладают силы притяжения между молекулами.
На близких расстояниях возникают короткодействующие взаимодействия электронных оболочек молекул. Возникающие при этом взаимодействия относятся к специфическим, потому что они характеризуются избирательностью и химической природой взаимодействия между атомами разных молекул. Именно специфические межмолекулярные взаимодействия оказывают существенное влияние на спектрально-молекулярные свойства молекул.
