
- •Введение
- •Основные закономерности химико-технологического процесса.
- •Основные технологические понятия.
- •Технологическая схема.
- •Равновесие в химико-технологическом процессе.
- •Скорость химико-технологических процессов.
- •Кинетика гетерогенных химических реакций.
- •1. Теоретические основы составления балансов хтп.
- •1.1. Классификация хтс:
- •О тсюда
- •1.5. Общие принципы составления материальтного и теплового баланса.
- •1.6. Классификация систем по виду уравнения Данкелера.
- •1 .7. Использование уравнения Дамкелера для составления математической модели хтп.
- •1.8. Совместимость понятий при рассмотрении хтп.
- •2. Катализ в химической технологии.
- •2.2. Гомогеный катализ и его скорость.
- •Способы осуществления экзотермической каталитической реакции по линии оптимальных температур.
- •Химические реакторы.
- •Основные требования к промышленным реакторам.
- •Технологическая классификация.
- •Математические модели основных типов химических реакторов.
- •Реактор периодического действия (рпд).
- •Реакторы непрерывного действия.
- •С с равнение трёх типов реакторов.
- •Каскад реакторов идеального смешения.
- •4. Реальные химические реакторы.
- •4.1.Масштабирование реальных химических реакторов.
- •4.2.Типовые конструкции химических реакторов.
- •4.3.Реакторы для проведения гомогенных реакций в жидкой фазе.
- •4.4.Реакторы для проведения реакций в системе газ/жидкость.
- •4.5.Реакторы для проведения реакций в системе газ/твёрдая фаза.
- •4.6.Реакторы для проведения газовых реакций.
- •4.7.Промышленные печи.
- •5.Сырьё, вода и энергия в химической промышленности.
- •5.1.Сырьё.
- •5.2.Вода.
- •6.Технология серной кислоты.
- •6.1.Нитрозный способ образования серной кислоты.
- •6.2.Контактный метод получения серной кислоты.
- •6.3.Метод двойного контактирования.
2.2. Гомогеный катализ и его скорость.
Может протекать в газовой или жидкой фазе. Механизм заключается в образовании между реагентом и катализатором промежуточных соединений, существующих в той же фазе.
В растворах чаще всего катализ происходит по ионному механизму (кислотно - основного взаимодействия); в газовой фазе по ОВ механизму.
A+BR
A+kt↔Akt* k1, k2
A kt*+BABkt* k3
kt*+BABkt* k3
A Bkt*kt+R k4
Bkt*kt+R k4
П редположим,
что процесс идёт в стационарном режиме,
т.е. комплекс образуется постоянно.
редположим,
что процесс идёт в стационарном режиме,
т.е. комплекс образуется постоянно.
Скорость образования Akt*:
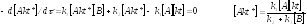
![]()
2.3. Гетерогенный катализ (ГК).
По фазовому признаку различают следующие виды ГК:
-
Использование жидкого катализатора, ускоряющего реакцию между двумя несмешивающимися жидкостями;
-
Использование твёрдого катализатора, ускоряющего реакцию между жидкими или газообразными реагентами.
О тличие.
При ГК промежуточное соединение возникают
на поверхности катализатора и перед
тем, как комплексы соединяются добавляется
стадия адсорбции (десорбции). Оба эти
процесса идут с изменением энергии
системы.
тличие.
При ГК промежуточное соединение возникают
на поверхности катализатора и перед
тем, как комплексы соединяются добавляется
стадия адсорбции (десорбции). Оба эти
процесса идут с изменением энергии
системы.
Энергетическая диограмма гетерогенного катализа.
1 - Энергетическое состояние исходных реагентов. Первая стадия процесса на энергетической диаграмме - стадия адсорбция исходных реагентов на поверхности зерна катализатора.
2 - Энергетическое состояние исходных реагентов, адсорбированных на поверхности катализатора.
3 - Адсорбированные промежуточные комплексы на поверхности катализатора.
4 - Продукты, адсорбированные на поверхности катализатора.
2-3 Еист - истинная энергия активации каталитической реакции.
1-3 Екаж - кажущаяся энергия активации.
Еист = Екаж +Надс
5 - Энергетическое состояние продуктов.
Ндес - тепловой эффект десорбции.
Физические стадии ГК.
1 - Внешняя диффузия реагирующих веществ
из ядра потока к внешней поверхности
зерна катализатора.
- Внешняя диффузия реагирующих веществ
из ядра потока к внешней поверхности
зерна катализатора.
2 - Внутренняя диффузия реагентов в порах зерна катализатора.
3 - Адсорбция исходных реагентов на внутренней и внешней поверхности с образованием поверхностно активных комплексов состава реагент-катализатор.
4 - Перегруппировка атомов с образованием с образованием комплексов продукт-катализатор.
5 - Десорбция продуктов с внешней и внутренней поверхности зерна катализатора.
6 - Диффузия продуктов в порах зерна катализатора.
7 - Внешняя диффузия продуктов в ядро потока.
Общая скорость гетерогенного каталитического процесса определяется скоростями его отдельных стадий и может лимитироваться медленной.
Если скорость самой ХР больше скорости диффузии, то скорость всего процесса в целом будет определяться скоростью диффузии, значит кинетика процесса будет описываться уравнениями диффузии.
Если скорость диффузии намного больше скорости ХР, то в целом скорость всего процесса будет лимитироваться скоростью ХР, т.е. подчиняться химической кинетике.
С учётом неравнодоступности поверхности (внешней и внутренней). Различают случаи:
-
Скорость процесса лимитируется внешней диффузией (1, 7).
-
Скорость лимитируется внутренней диффузионной областью (2,6).
-
Процесс лимитируется внешней кинетической областью (3, 4).
-
Процесс лимитируется внутренней кинетической областью (3, 4, 5).
Влияние технологических факторов на скорость гетерогенного каталитического процесса.
1. Если процесс лимитируется внешней диффузионной областью, это означает, что концентрация реагирующих веществ даже на поверхности зерна, а тем более в порах, гораздо меньше, чем в ядре потока.
Ч тобы
увеличить скорость необходимо:
тобы
увеличить скорость необходимо:
-
увеличить концентрацию потока;
-
увеличить турбулизацию потока.
2. Если процесс лимитируется внутренней диффузионной областью.
Концентрации реагирующих веществ в ядре потока и на внешней поверхности весьма близки, но в порах концентрация резко падает.
![]()
В данном случае для интенсификации процесса нужно: либо уменьшить размер зерна катализатора, либо увеличить размер пор, т.е. провести мероприятия, связанные с изготовлением катализатора.
В газовых растворах – с увеличением давления.
3. Если процесс лимитируется внешней кинетической областью.
В этом случае концентрации реагирующих веществ на внешней поверхности катализатора и в ядре потока равны, но вследствие чрезвычайно высокой скорости химической реакции, она идёт только на внешней поверхности зерна.
![]()
Скорость процесса будет определяться законами химической кинетики.
4. Если процесс внутренней кинетической областью.
Концентрации вещества на поверхности, в ядре потока и внутри пор одинаковы. В этом случае скорость процесса зависит только от скорости химической реакции.
В данном случае скорость процесса можно изменять за счёт использования температуры, концентрации, давления.
Влияние температуры.
1. Если прямая реакция эндотермическая, то увеличение скорости процесса достигается при увеличении температуры реакционной смеси. Крайней будет температура, при которой катализатор разрушается.
![]()


-
Если реакция экзотермическая.
![]()
![]() ––
это температура,
при которой процесс идёт с максимально
возможной скоростью при максимально
большом выходе. Эту
температуру в процессе перескакивать
нельзя.
––
это температура,
при которой процесс идёт с максимально
возможной скоростью при максимально
большом выходе. Эту
температуру в процессе перескакивать
нельзя.
ЛОТ – линия оптимальных температур.


![]()
![]()
![]()
![]()
Линия оптимальных температур показывает, какой выход мы можем достигнуть при данной температуре с максимально возможной скоростью. Это та линия, вдоль которой необходимо осуществлять экзотермический процесс.
