
- •Введение
- •Основные закономерности химико-технологического процесса.
- •Основные технологические понятия.
- •Технологическая схема.
- •Равновесие в химико-технологическом процессе.
- •Скорость химико-технологических процессов.
- •Кинетика гетерогенных химических реакций.
- •1. Теоретические основы составления балансов хтп.
- •1.1. Классификация хтс:
- •О тсюда
- •1.5. Общие принципы составления материальтного и теплового баланса.
- •1.6. Классификация систем по виду уравнения Данкелера.
- •1 .7. Использование уравнения Дамкелера для составления математической модели хтп.
- •1.8. Совместимость понятий при рассмотрении хтп.
- •2. Катализ в химической технологии.
- •2.2. Гомогеный катализ и его скорость.
- •Способы осуществления экзотермической каталитической реакции по линии оптимальных температур.
- •Химические реакторы.
- •Основные требования к промышленным реакторам.
- •Технологическая классификация.
- •Математические модели основных типов химических реакторов.
- •Реактор периодического действия (рпд).
- •Реакторы непрерывного действия.
- •С с равнение трёх типов реакторов.
- •Каскад реакторов идеального смешения.
- •4. Реальные химические реакторы.
- •4.1.Масштабирование реальных химических реакторов.
- •4.2.Типовые конструкции химических реакторов.
- •4.3.Реакторы для проведения гомогенных реакций в жидкой фазе.
- •4.4.Реакторы для проведения реакций в системе газ/жидкость.
- •4.5.Реакторы для проведения реакций в системе газ/твёрдая фаза.
- •4.6.Реакторы для проведения газовых реакций.
- •4.7.Промышленные печи.
- •5.Сырьё, вода и энергия в химической промышленности.
- •5.1.Сырьё.
- •5.2.Вода.
- •6.Технология серной кислоты.
- •6.1.Нитрозный способ образования серной кислоты.
- •6.2.Контактный метод получения серной кислоты.
- •6.3.Метод двойного контактирования.
Введение
Химическая технология – это область химических наук, которая изучает процессы изменения состава и внутренней структуры вещества, осуществляемые путем химической реакции.
Эта наука изучает методы и средства оптимальной переработки химического сырья в предметы потребления и средства производства.
В отличии от других химических наук она собрала в себе все науки, но частично.
Методы - это изучение самой химической реакции, лежащей в основе производства.
Средства - это аппаратура, на которой осуществляется производство.
Химическое производство состоит из следующих стадий:
1. подготовка сырья;
2. химико – технологический процесс;
3. выделение целевого продукта;
4. очистка выбросов.
Целевой продукт (R) - продукт, ради которого осуществляется данная химическая технология.
Побочный продукт (S) – продукт, образующийся наряду с целевым, который образуется в ходе параллельной реакции химической технологии.
Все эти стадии осуществляются типовыми процессами.
Группы типовых процессов:
1) механические (дробление, классификация, грохочение). Используется на стадии подготовки сырья;
2) гидродинамические (процессы движение жидкостей и газов по трубопроводам и аппаратам, процессы разделения жидкостей - адсорбция, адсорбция, осаждение, фильтрация, циклоны, кипящий слой). Их особенность состоит в том, что они основаны на одной и той же теоретической базе. Используется на всех стадиях химического производства.
Закон Ньютона:
![]()
![]()
Движущая сила процесса - скорость
3) тепловые (нагревание и охлаждение материальный потоков, сушка, выпаривание).! Основную роль играет на стадии выделении целевого продукта, а побочную роль на всех остальных.
Закон Фурье:
![]()
Формула Движущая сила процесса - время
4) массообменные или диффузионные процессы (абсорбция, десорбция, адсорбция, сушка, ректификация, кристаллизация) !Используются на стадии выделения целевого продукта и очистке выбросов.
Закон Фика:
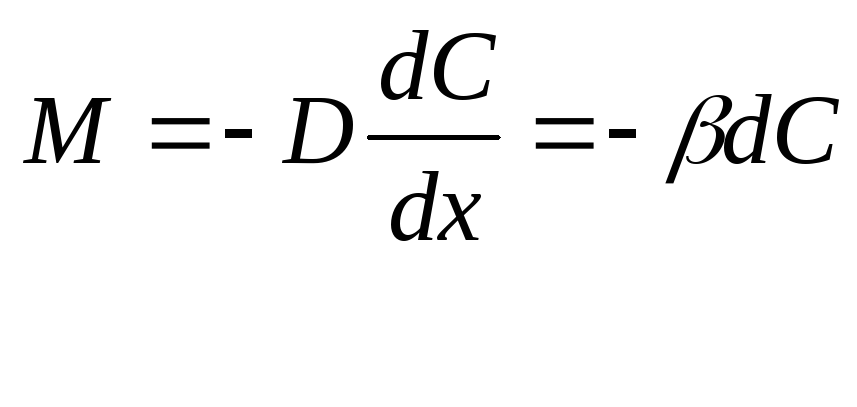
Движущая сила процесса - разность концентраций
-
химические (связаны с осуществлением самой химической реакции).Используется на стадиях химико-технологического процесса и очистке выбросов.
Скорость химической реакции:
![]()
![]()
Для всех законов и процессов нужно знать:
1. кинетику физических процессов;
-
для получения конечного результата нужно знать как рассчитываются:
а) основные размеры – для типовых процессов – механических, гидродинамических, тепловых, массообменных;
б) химические дисциплины – для химических процессов.
Порядок проектирования нового химического производства состоит:
1. синтез нового продукта в лабораторных условиях;
2. микрокинетика данной химической реакции, которая изучается в лабораторных условиях и включает в себя:
а) определение маршрутов химической реакции;
б) определение констант химической реакции;
в) определение порядка химической реакции.
Все эти стадии изучаются в «чистом» виде, вне влияния тепловых и диффузионных процессов.
3. изучение макрокинетики (изучается на укрупненных опытных или промышленных установках), для того, чтобы определить влияние на химическую кинетику условий организации движения потоков, их перемешивания , а также сопутствующих тепловых и диффузионных параметров.
Макрокинетика начинается с выбора типа аппарата и его математической модели. Эта часть исследований ведется с учетом данных микрокинетики. Конечной целью этой стадии является составление полной математической модели химического реактора, позволяющей получить представления о возможных вариантах течения процесса, выявить максимально выгодный режим и сформулировать четкие условия по его удержанию в ходе процесса.
Изучение макрокинетики и микрокинетики процессов позволяют рассчитать размеры аппаратов, реакторов, определиться с последовательностью осуществления процесса и спроектировать технологическую схему производства.
Классификация химических производств:
1. высокотемпературные - например, металлургическое и коксохимическое производство при температуре более 10000С;
-
электрохимические - получение водорода;
3. каталитические;
4. химические производства, идущие под повышенным или под пониженным давлением. Эти производства, в основе которых лежат газовые химические реакции. Например, синтез аммиака.
5. биохимические производства - например, процесс брожения;
-
фотохимические производства, в основе которых лежат реакции, осуществляемые при отсутствии света или его наличии.
